
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод валентных связей. Метод молекулярных орбиталей
Метод валентных связей.
Метод валентных связей впервые был использован в 1927 г. Немецким учеными В. Гейтлером и Ф. Лондоном, которые провели квантово-механический расчет атома водорода. В методе ВС предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. Гейтлер и Лондон показали, что при сближении двух атомов водорода с антипаралельными спинами происходит уменьшение энергии системы, что обусловлено увеличением электронной плотности в пространстве между ядрами взаимодействующих атомов. При сближении атомов с параллельными спинами энергия системы возрастает и молекула в этом случае не образуется. Метод ВС базируется на следующих основных положениях: 1) химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар. 2) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами вносит основной вклад в энергию химической связи. Дополнительный вклад дают кулоновские силы взаимодействия частиц. 3) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипаралельными спинами. 4) характеристики химической связи определяются типом перекрывания АО.
Рассмотренный метод ВС обладает многими достоинствами. Он относительно прост и нагляден и позволяет предсказывать свойства многих молекул, таких как пространственная конфигурация, полярность, энергия и длина связей и др. Однако свойства некоторых молекул и ионов метод ВС объяснить не в состоянии. В методе ВС постулируется участие в образовании связей пары электронов, в то же время существуют свободные радикалы, молекулярные ионы, такие как Н2, Не2, О2, которые имеют неспаренные электроны. О наличии неспаренных электронов можно судить по магнитным свойствам веществ. Вещества, имеющие неспаренные электроны, парамагнитные, т.е. втягиваются в магнитное поле. Вещества, не имеющие неспаренных электронов, диамагнитные, т.е. выталкиваются из магнитного поля. Согласно методу ВС молекула кислорода не имеет неспаренных электронов, между тем кислород парамагнитен.
Более общим является метод молекулярных орбиталей (МО), позволяющий объяснить ряд явлений и фактов непонятных с точки зрения метода ВС.Основные понятия. Согласно методу МО электроны в молеку-. лах распределены по молекулярным орбиталям, которые подобно (атомным орбиталям (АО) характеризуются определенной энергией (энергетическим уровнем) и формой. В отличие от АО молекулярные орбитали охватывают не один атом, а всю молекулу, т.е. являются двух- или многоцентровыми. Если в методе ВС атомы молекул сохраняют определенную индивидуальность, то в методе МО молекула рассматривается как единая система.
Наиболее широко в методе МО используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдается несколько правил.
1. Число МО равно общему числу АО, из которых комбинируются МО.Энергия одних МО оказывается выше, других — ниже энергии исходных АО. Средняя энергия МО, полученных из набора АО, приблизительно совпадает со средней энергией этих АО.
3. Электроны заполняют МО, как и АО, в порядке возрастания энергии, при этом соблюдается принцип запрета Паули и правило Гунда.
4. Наиболее эффективно комбинируются АО с теми АО, которые характеризуются сопоставимыми энергиями и соответствующей симметрией.5. Как и в методе ВС, прочность связи в методе МО пропорциональна степени перекрывания атомных орбиталей.
16. . Типы связи σ-, π-, δ- связь.
В зависимости от направления перекрывания атомных орбиталей различают σ-, π- и δ-связи.
σ-Связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов (рис. II.4). Простейший случай σ-связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (рис. II.4,а). Вследствие сферической формы s-орбиталей два s-электрона могут образовывать только такую связь, при которой перекрывание атомных орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может возникнуть также при перекрывании s- и р-орбиталей (рис. 11.4,6), двух р-орбиталей (рис. 11,4, в), двух d-орбиталей (рис. II.4, г) d- и s-орбиталей и d- и р-орбиталей. σ-Связь возникает, если атомные р- и d-opбитали ориентированы вдоль оси связи.

Рис. II.4. Перекрывание различных электронных
облаков при образовании σ–связи
π-Связь осуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двух р-орбиталей (рис. II.5, а), расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания. Соответственно π-связь характеризуется двумя областями перекрывания, расположенными по обе стороны оси, соединяющей ядра атомов. π-Связь также может образоваться при перекрывании р- и d-орбиталей (рис. 11.5,6) или двух d-opбиталей (рис. П.5,в).
δ-Связь возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях (рис. II.6). Таким образом, s-электроны могут участвовать лишь в образовании σ-связи, р-электроны — в образовании σ- и π-связей, a d-электроны — как в образовании σ- и π-связей, так и δ-связей. Еще более разнообразны способы взаимодействия f-электронов.
π- и δ-Связи налагаются на σ-связи, вследствие чего образуются двойные и тройные связи.
Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это обусловлено разницей в энергии σ- и π-связей.
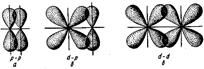
Рис. II.5. Перекрывание электронных
облаков при образовании π-связи

Рис. II.6. Перекрывание электронных
облаков при образовании δ-связи
|
|
Дата добавления: 2015-04-24; Просмотров: 3023; Нарушение авторских прав?; Мы поможем в написании вашей работы!