
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм процесса восстановления
|
|
|
|
Связь показателей восстановления и расхода кокса.
Ход процесса восстановления существенно влияет на тепловую работу печи, а следовательно на расход горючего углерод расходуется как восстановитель и как теплоноситель – для возмещения затрат тепла на проведение эндотермических реакций прямого восстановления.
Для наиболее простых условий (при отсутствии водорода, карбонатов и пр)
Р = Oш/Сг = Oш/(CO+CO2)
q = 0,5*hCO.
тогда Ri = 0.5(CO+CO2) hCO/ Oш
значение CO+CO2 является величиной, близкой к к расходу углерода на процесс (т.е. это углерод поступивший в печь за вычетом углерода, перешедшего в чугун и вынесенного с пылью. Oш – изменяется в узких пределах и для одной шихты практически постоянна.
тогда
Ri = a×КhCO
где К – расход кокса,
a = 0,5Ск(1-b)/ Oш
Ск – содержание углерода в коксе,
b – доля углерода, перешедшего в чугун и унесенного с пылью.
При постоянных условиях плавки, когда Ск, Ош и b постоянны, существует взаимосвязь расхода кокса в печи и двух показателей степени непрямого восстановления и степени использования химической энергии газа. Существует два пути роста Ri: увеличение количества газа-восстановителя, что связано с повышением расхода кокса и экономически невыгодно, однако оправдано при вдувании в печь углеводородов и улучшение использования газа в печи.
Сегодня нет единой трактовки механизма восстановления окислов в доменной печи.
Наиболее исследован процесс восстановления куска руды в области умеренных температур.
В пространстве между кусками руды и в крупных порах течет газ-восстановитель.
· Для контакта с реакционной поверхностью газу-восстановителю нужно диффундировать по микропорам куска, а также через слой образовавшихся твердых продуктов восстановления внутрь куска. Газообразные продукты тем же путем отводятся из зоны реакции. Для описания диффузии через граничный слой газа толщиной l используется коэффициент массопередачи.
b = D/l, где D – коэффициент диффузии газа восстановителя
Коэффициент диффузии газов 1 и 2 в бинарной смеси
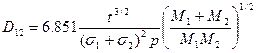
где t – температура, °С
р – давление, кПа
М1 и М2 – молекулярные массы газов
s1 и s2 - диаметры молекул газа, Å.
При диффузии в порах удары молекул о стенки поры, будут чаще, чем столкномения молекул такое движение называется кнудсеновским или молекулярным, коэффициент кнудсеновской диффузии
Dk = 8/3d(RT/2pM)1/2
где d – эффективный размер поры.
· Далее необходима адсорбция газа-восстановителя на поверхности твердой фазы. На этой поверхности протекает реакция восстановления, включающая отнятие кислорода от окисла, образование и рост зародышей продуктов восстановления – магнетита, вюстита и железа.
· Последующее наращение слоя продуктов реакции происходит в результате твердофазных реакций и диффузии в твердой фазе. Диффузия преимущественно протекает по вакансиям кристаллической решетки вюстита.
Движущей силой на каждом этапе является отклонение от положения равновесия. Например, для диффузии - это разность концентраций (или давления) реагентов в начале и в конце диффузионного пути. Важное значение имеет определение лимитирующей стадии.
По С.Т. Ростовцеву критерием является показатель S = (ka/Db)1/2×r0
где r0 – исходный размер окисного шара.
k – константа скорости химической реакции
a – удельная поверхность пор
D – коэффициент диффузии газа через поры
b – удельный объем пор.
если S<0.1 – процесс идет в кинетическом режиме
если S>40 – процесс идет в диффузионном режиме скорость лимитируется подводом газа-восстановителя к реакционной поверхности.
В промежуточной области при низких температурах – кинетический режим, при высоких – диффузионный.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 576; Нарушение авторских прав?; Мы поможем в написании вашей работы!