
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость
|
|
|
|
Калорическое и термическое уравнения состояния.
Равновесным внутренним параметром ТДС является функция внешних параметров и температуры. Отсюда следует существование уравнений состояния.
Выделяют 2 основных:
Уравнением состояния называют уравнение, связывающее внутренний параметр bк с внешним параметром аi и t.
bк = f (а1, …, an, T) (1)
Если внутренний параметр bк является внутренней энергией, то уравнение состояния U=U(a1,a2,…an, T) (2) называется калорическим состоянием.
Название исходит из того, что через него находят теплоемкость и др. величины измеряемые калориями.
Если внутренний параметр bк является соответствующая внешнему параметру аi обобщённая сила Fi, то уравнение Fi = f (а1, …, an, T) (3) называется термическим уравнением.
Название происходит из того, что с помощью него удаётся выразить температуру.
Общее число калорических и термических состояний равно числу её степеней свободы, то есть числу независимых параметров и функций, характеризующих параметры системы.
Если известно калорическое и термическое состояние, то с помощью начал термодинамики можно определить все термометрические свойства вещества.
Уравнения состояния находятся из опыта или выводятся методами статистической физики.
Определяется, как количество теплоты необходимое для изменения температуры системы на 1К°.
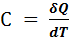 (1)
(1)
Сама теплоемкость зависит от характеристики подвода тепла.
Теплоёмкость показывает какое кол-во теплоты необходимо передать системе, чтобы повысить её температуру на 1°.
Рассмотрим простую ТДС, у которой 1 внешний параметр а, внешняя сила F, Т, заданы калорическое и термическое уравнения.
δA = F*da
F = δA / da
U = U (a, T) (5)
F = F (a, T) (6)
34. Вывод соотношения для 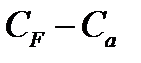 .
.
В термодинамике важную роль играет определение двух теплоёмкостей:
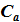 – теплоёмкость при постоянном а
– теплоёмкость при постоянном а
 – теплоёмкость при постоянном F
– теплоёмкость при постоянном F
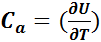 a (1)
a (1)
 T
T  F (2)
F (2)
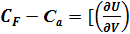 T + F
T + F  F (3)
F (3)
35. Вывод соотношения для  в случае идеального газа.
в случае идеального газа.
Для определения Сv достаточно знать калорическое состояние. А для Сp – как калорическое, так и термическое состояние.
В термодинамике принимают Са = (δU / δT)а > 0, это означает, что тело с большей теплоёмкостью имеет большую энергию.
Сv > 0
Калорическое состояние выводится из эксперимента.
U = СvT + U0 (1)
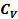 – теплоёмкость при постоянном объёме
– теплоёмкость при постоянном объёме
U0 – некоторая const
У одноатомного идеального газа теплоёмкость не зависит от температуры U0 = const.
Термическое уравнение состояния – уравнение Менделеева-Клапейрона.
pV = νRT (2)
ν = m / μ (3)
 T = 0;
T = 0;
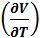 p =
p =  p =
p = 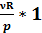
 p =
p = 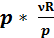 = νR
= νR
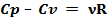 (4)
(4)
Полагая, что ν=1 для 1 моля газа, получаем:
Cp - Cv = R (5)
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 381; Нарушение авторских прав?; Мы поможем в написании вашей работы!