
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибридизация атомных орбиталей. Теория полной гибридизации Гиллеспи
|
|
|
|
Кратные связи. Делокализация связи
Связи
В зависимости от направления перекрывания атомных орбиталей различают σ-, π- и δ-связи.
σ-Связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов (рис. II.4). Простейший случай σ-связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (рис. II.4,а). Вследствие сферической формы s-орбиталей два s-электрона могут образовывать только такую связь, при которой перекрывание атомных орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может возникнуть также при перекрывании s- и р-орбиталей (рис. 11.4,6), двух р-орбиталей (рис. 11,4, в), двух d-орбиталей (рис. II.4, г) d- и s-орбиталей и d- и р-орбиталей. σ-Связь возникает, если атомные р- и d-opбитали ориентированы вдоль оси связи.
Рис. II.4. Перекрывание различных электронных
облаков при образовании σ—связи
π-Связь осуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двух р-орбиталей (рис. II.5, а), расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания. Соответственно π-связь характеризуется двумя областями перекрывания, расположенными по обе стороны оси, соединяющей ядра атомов. π-Связь также может образоваться при перекрывании р- и d-орбиталей (рис. 11.5,6) или двух d-opбиталей (рис. П.5,в).
δ-Связь возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях (рис. II.6). Таким образом, s-электроны могут участвовать лишь в образовании σ-связи, р-электроны — в образовании σ- и π-связей, a d-электроны — как в образовании σ- и π-связей, так и δ-связей. Еще более разнообразны способы взаимодействия f-электронов.
π- и δ-Связи налагаются на σ-связи, вследствие чего образуются двойные и тройные связи.
Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это обусловлено разницей в энергии σ- и π-связей.
____________
ГИБРИДИЗАЦИЯАТОМНЫХОРБИТАЛЕЙ, квантовохим. способ описания перестройки орбиталей атома в молекуле по сравнению со своб. атомом. Являясь формальным мат. приемом, гибридизация атомных орбиталей позволяет отразить нарушение сферич. симметрии распределенияэлектронной плотности атома при образовании хим. связи. Сущность гибридизации атомных орбиталей состоит в том, что электрон молекулывблизи выделенного атомного ядра характеризуется не отдельной атомной орбиталью (АО), а линейной комбинацией атомных орбита-лей с разл. значениями азимутального и магнитного квантовых чисел. Такая линейная комбинация наз. гибридной (гибридизированной) орбиталью (ГО). Как правило, гибридизация затрагивает лишь высшие и близкие по энергии занятые АО своб. атома. Напр., для атомов элементов второго периода периодич. системы типичная форма ГО 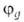 -линейная комбинация 2s-орбитали
-линейная комбинация 2s-орбитали  и 2р-орбиталей
и 2р-орбиталей 
 ,
, 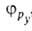
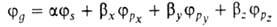 ,
, 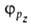 с численными коэффициентами
с численными коэффициентами  и
и
ГО обладают более низкой симметрией, чем составляющие их АО. Так, распределение электронной плотности, отвечающее указанной ГО  , смещено от атомного ядра в направлении вектора п с координатами
, смещено от атомного ядра в направлении вектора п с координатами 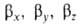 ; вектор п является осью симметрии ГО (рис. 1). При изменении ориентации в пространстве осей координат коэффициенты линейной комбинации могут изменяться, однако остается постоянным отношение сумм квадратов коэффициентов для данного значения азимутального квантового числа. Это отношение определяет тип ГО. Напр., орбиталь
; вектор п является осью симметрии ГО (рис. 1). При изменении ориентации в пространстве осей координат коэффициенты линейной комбинации могут изменяться, однако остается постоянным отношение сумм квадратов коэффициентов для данного значения азимутального квантового числа. Это отношение определяет тип ГО. Напр., орбиталь  относится к типу sapb, где а и b- числа, подобранные так, чтобы
относится к типу sapb, где а и b- числа, подобранные так, чтобы  . Обычно принимают а — 1, b = 1, 2 или 3.
. Обычно принимают а — 1, b = 1, 2 или 3.
Как правило, гибридные орбитали данного атома в молекуле относятся к одному типу, к-рый называют типом гибридизации атома. Так, атом N вмолекуле аммиака имеет гибридизацию типа sp3, атом С в молекуле этилена - sp2-гибридизацию, атом С в молекуле ацетилена - sp-гибридизацию. Это дает основание отождествлять тип гибридизации атома в молекуле с символом его некоей гипотетич. электронной конфигурации.
Обычно система ГО строится таким образом, чтобы для разных орбиталей одного атома интегралы перекрывания были равны нулю (см.Молекулярные интегралы). Кроме того, каждая орбиталь в молекуле либо остается негибридизированной АО, либо выбирается гибридизированной по определенному типу. Этим требованиям удовлетворяют неск. наборов орбиталей. Напр., атом О в молекуле Н2О можно считать как sp2-, так и 5р3-гибридизированным. Оси симметрии всех орбиталей обычно образуют симметричную фигуру (см. рис. 2). Операции симметрии этой фигуры переводят ГО одного атома друг в друга. Такие ГО наз. эквивалентными. Напр., линейная комбинация четырех валентных АО атома С приводит к четырем 5р3-гибридным орбиталям, оси симметрии к-рых по отношению друг к другу расположены под углом 109,5°, т.е. направлены по углам тетраэдра (рис. 2, в).

Рис. 1. Гибридная орбиталь, образованная из 2s- и 2р-атомных орбиталей; х, у, z- координатные оси, п-ось симметрии.
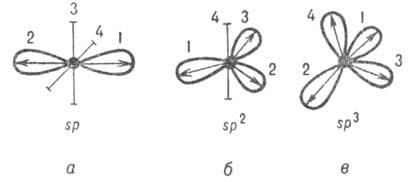
Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталейизображены отрезками. Стрелками указано направление смещения электронной плотности.
Представление о гибридизации атомных орбиталей используется для изучения закономерностей изменения электронной плотности молекулывблизи к.-л. атомного ядра в зависимости от его окружения, т.е. позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны разл. подходы к анализу этой связи. Если известно геом. расположение атомных ядер, расчет волновой ф-циимолекулы можно свести к изучению парных взаимод. соседних атомов (см. Валентных связей метод, Молекулярных орбиталей методы). Для такого расчета выбирают одну из возможных систем ГО и располагают ее в пространстве так, чтобы обеспечить макс. перекрывание отдельных пар ГО разных атомов. Другой подход применяется в неэмпирических методах квантовой химии, в к-рых все взаимод. атомов в молекуле учитываются одновременно и волновая ф-ция молекулы не зависит от того, атомные или гибридизированные орбитали используются для расчета. В этом случае ГО строят после определения волновой ф-ции молекулы таким образом, чтобы в отдельных областях пространства распределение электронной плотности можно было описать одной ГО. В обоих подходах тип гибридизации атомных орбиталей обусловлен геом. конфигурацией молекулы и для большинства равновесных конфигураций оба подхода приводят к близким формам ГО.
В теоретич. химии для систематизации эксперимент. данных о равновесных конфигурациях молекул часто применяют феноменологич. подход, в рамках к-рого атомы данного элемента склонны к гибридизации определенного типа, а тип гибридизации определяет взаимное расположение ядер ближайшего окружения. Отклонение конфигурации молекулы от симметричной связывают с взаимод. хим. связей (напр., с отталкиванием парэлектронов, образующих связь). В такой форме представления о гибридизации атомных орбиталей используются в стереохимии.
Понятие о гибридизации атомных орбиталей введено в химию Л. Полингом в 1931.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2349; Нарушение авторских прав?; Мы поможем в написании вашей работы!