
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дайте определение химической связи. Каковы общие представления о химической связи? Основные характеристики химической связи
|
|
|
|
Дайте определение валентности. От чего зависит валентность с современных представлений о строении атома. С чем связанна постоянная и переменная валентность элементов. Покажите на примере. Чем отличается валентность от степени окисления.
Что такое электроотрицательность? Понятие об относительной и абсолютной электроотрицательности. Как изменяется электроотрицательность р-элементов в периоде и группе периодической системы с увеличением порядкового номера?
Что такое энергия ионизации? Что такое сродство к электрону? Как изменяется окислительно-восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера?
Дайте определение атомного радиуса. Как изменяется атомный радиус в периодах и группах периодической системы химических элементов, в зависимости от типа химической связи и степени окисления элемента?
Принцип построения периодической системы элементов: периоды, ряды, группы и подгруппы. Какая закономерность является наиболее важной в периодической системе с позиции строения атомов элементов.
Принципы формирования электронных оболочек атомов: принцип Паули и следствия из него, правило Гунда, принцип наименьшей энергии и правила Клечковского. Что такое «проскок электрона»?
Принцип Паули (1925 г.): В атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел.
Из принципа Паули вытекают важные следствия.
Следствие 1. На атомной орбитали не может находиться более двух
электронов в соответствии с двумя значениями спинового квантового числа
mS= 1/2.
Следствие 2. Максимальное число электронов на данном подуровне:
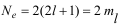
т.е. на каждом электронном подуровне находится количество электронов,
равное удвоенному значению магнитного квантового числа. Поскольку каждый подуровень содержит 2l +1 орбиталей, которые могут заселять только 2 электрона, тогда максимально число электронов на подуровне будет равно:
s- подуровень имеет 1 AO, следовательно, содержит 2е;
p- подуровень имеет 3 AO, следовательно, содержит 6е;
d- подуровень имеет 5 AO, следовательно, содержит 10е;
f- подуровень имеет 7 AO, следовательно, содержит 14е.
Следствие 3. Максимальное число электронов на уровне равно
удвоенному значению квадрата главного квантового числа n:
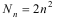
Эта формула получается после того, как мы просуммируем число
электронов при заданном l от 0 до n-1 (формула Борна-Бьюри):
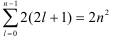
Она не учитывает межэлектронное взаимодействие и справедлива при 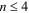 .
.
Правило Гунда: На данном подуровне электроны располагаются таким образом, чтобы суммарное спиновое число их было максимальным, т.е. только в этом случае электронная конфигурация обладает наименьшей энергией. При этом надо помнить, что суммарное спиновое число спаренных электронов равно нулю. Это означает, что если на d-подуровне находится 7e, то они располагаются так:

В противном случае суммарный спин будет меньше:

Принцип наименьшей энергии: Электроны в атоме не должны занимать вышестоящих энергетических уровней до тех пор, пока в нижележащих имеются свободные места, располагаясь на которых электроны будут обладать меньшей энергией. Этот принцип отражает общую закономерность – максимуму устойчивости системы соответствует минимум её энергии. Однако в такой формулировке принципом наименьшей энергии
пользоваться весьма сложно. В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырёх квантовых чисел, но в этом случае электрон находится не только в поле ядра, а также в поле других электронов. Поэтому, учитывая, что энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, советским физиком В. М. Клечковским в 03..гг ХХ века были разработаны два правила, существенно облегчившие задачу размещения электронов в атомах:
1. Электроны сначала занимают те уровни и подуровни, для которых
сумма чисел n+l меньше.
2. Если для каких-либо подуровней суммы n+l равны, то вначале идёт
заполнение того подуровня, для которого число n имеет меньшее значение.
Эффект «проскока электрона» является исключением из правил Клечковского, но соответствует принципу минимума энергии, он обусловлен близостью по энергии (n-1)d и ns подуровней, а так же повышенной устойчивостью полностью или наполовину заполненных d-подуровней (d10 или d5). Элементы с «проскоком электрона»: Cu, Ag, Au, Cr, Mo, Pt.
5. Периодический закон в формулировке Менделеева. Достоинства и недостатки закона. Почему в периодической таблице химические элементы расположены: K за Ar, I за Te, Ni за Co? Роль закона Мозли в развитии о периодической системе элементов. Современная формулировка периодического закона.
Изучая изменение химических свойств элементов в зависимости от величины их относительных атомных масс (атомного веса), Д. И. Менделеев в 1869 г. составляет периодическую систему элементов, а затем формулирует Периодический закон – один из основных законов природы: свойства элементов, а потому и свойства образуемых ими простых и сложных соединений находятся в периодической зависимости от их атомных масс. Этот закон позволил провести не только строго научную классификацию элементов, уточнить значения атомных масс и валентностей некоторых из них, но он еще обладал огромной предсказательной способностью при открытии новых элементов. Однако, наряду с бесспорными достоинствами периодического закона, имелись и существенные недостатки, которые ни Д. И. Менделеев, ни его последователи не могли объяснить, например, аномальное расположение элементов: Ar и K, Co и Ni, Te и I. Только в 1913-1916 гг.после работ английского физика Мозли удалось понять эти аномалии. Исследуя рентгеновское излучение атомов, Мозли установил закон: корень квадратный из частоты рентгеновского излучения пропорционален порядковому номеру элемента. Следовательно, основной характеристикой атома является ни его атомная масса (по Менделееву), а заряд ядра. Поскольку химические свойства элементов обусловлены строением электронных оболочек атомов, то периодическая система Менделеева представляется естественной классификацией элементов по их электронным структурам. Но при образовании химической связи электроны перераспределяются между атомами, а заряд ядра остаётся неизменным, поэтому современная формулировка периодического закона гласит: свойства элементов, а также простых и сложных соединений находятся в периодической зависимости от зарядов ядер их атомов.
Периодическая система состоит из периодов, рядов и групп.
Период – горизонтальный ряд элементов, имеющий одинаковое число энергетических уровней (электронных слоёв), номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя). Периодов в системе 7, их них 1-3 короткие, 4 -7 длинные, которые имеют чётные и нечётные ряды. Каждый период начинается типичным металлом (щелочным элементом), имеющим электронную конфигурацию ns1, а при переходе слева направо происходит постепенное ослабление металлических и нарастание неметаллических свойств; заканчивается период благородным газом (ns2np6). По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – A, состоящие из s- и p-элементов, и побочные – B -подгруппы, содержащие d - и f-элементы. Подгруппа II IB, кроме d-элементов, содержит по 14 4 f и 5 f -элементов. Это семейства лантаноидов и актиноидов соответственно. Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы. В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s- и p-орбиталях внешнего энергетического уровня, в побочных – на s -орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f -элементов валентными являются (n-2)f, (n-1)d и sn- электроны, где n равно 6 или 7 для лантаноидов и актиноидов соответственно. Сходство элементов внутри каждой подгруппы – наиболее важная закономерность в периодической системе; они называются элементами – аналогами.
Абсолютный радиус атома нельзя измерить, так как электроны обладают двойственной природой. Поэтому за радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента. В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром, так как происходит одновременное увеличение положительного заряда ядра и отрицательного заряда, создаваемого электронами. В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек. В связи с этим возрастают и металлические свойства элементов.
При изучении строения молекул было установлено, что радиусы атомов существенно зависят от типа химической связи и степени окисления элемента. Следовательно, чем больше перекрытие электронных облаков атомов при образовании молекул, тем меньше радиус атома. Аналогичная ситуация наблюдается при изменении степени окисления элементов – радиусы уменьшаются при увеличении степени окисления.
У элементов главных подгрупп радиусы атомов действительно существенно изменяются как при переходе вдоль периода слева направо (они уменьшаются), так и в группах сверху вниз (они увеличиваются). В побочных подгруппах изменения радиусов сверху вниз происходит не столь заметно, что объясняется, с одной стороны, эффектом экранирования, когда валентные электроны заполняют d- и f-подуровни внутренних энергетических уровней, а с другой стороны, эффектом d- и f-сжатия – постепенным уменьшением вдоль периода атомных и ионных радиусов.
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбуждённого атома или иона. Энергия ионизации I выражается в кДж∙моль-1. Энергия ионизации характеризует металлические (восстановительные) свойства элементов. Чем меньше энергия ионизации, тем в большей мере элемент проявляет металлические свойства.
Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Она характеризует способность атомов проявлять неметаллические свойства. Чем больше
электронное сродство, тем более сильным окислителем является данный элемент. Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных оболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы). Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2p2 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
Электроотрицательность – это количественная мера стремления данного атома к присоединению электронов, участвующих в образовании химической связи. При определении значения относительной электроотрицательности различных элементов за единицу принята ЭО лития, равная 1. Чем выше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства. Внутри групп электроотрицательность уменьшается - металлические свойства элементов возрастают сверху вниз.
Классическое определение: Валентность – это свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента при образовании химической связи в молекуле.
Современное определение: Валентность элемента определяется числом неспаренных электронов в его атоме.
Существуют элементы с постоянной и переменной валентностью. Атомы многих элементов могут увеличивать свою валентность (число неспаренных электронов) в результате перехода из основного в возбуждённое состояние. Возбуждённое состояние атома – это состояние с более высокой энергией, чем основное.
Рассмотрим атомы кислорода и серы. Они имеют одинаковую электронную конфигурацию внешнего энергетического уровня потому, что находятся в главной подгруппе VI A группы:
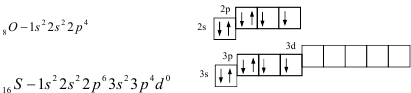
В основном (невозбуждённом) состоянии они имеют по два неспаренных электрона на внешнем энергетическом уровне и поэтому имеют одинаковую валентность, равную двум.
Однако атом серы может перейти в возбуждённое состояние (при получении дополнительной энергии) за счет перехода электронов с 3s- и 3p- подуровней на свободные орбитали 3d-подуровня:
Основное состояние
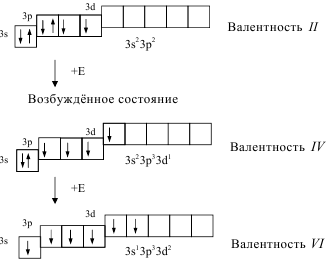
Это является причиной переменной валентности серы. Причём распаривание электронов и переход их с одного подуровня на свободную орбиталь другого подуровня может осуществляться только в пределах одного и того же энергетического уровня.
Другая ситуация наблюдается для атома кислорода. Он не может перейти в возбуждённое состояние, потому что на втором энергетическом уровне отсутствует d-подуровень, т.е. нет свободных орбиталей, на которые могли бы перейти электроны. Именно поэтому валентность кислорода постоянна во всех его соединениях.
Валентность - это свойство атомов образовывать хим. связи, а степень окисления - условный заряд атомов хим. элемента в соединении, вычисленный на основе предположения того, что все соединения состоят из ионов.
Силы, удерживающие молекулы в веществах получили название химической с вязи. Согласно предельно упрощенным теориям строения молекул, основанные на теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего создается электронная конфигурация инертного газа: ns2np6 или электронная структура ns2, за счет образования общих электронных пар или за счет образования ионов.
Образование из атомов молекул, сложных ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими (свободными) атомами. При этом минимальной энергии соответствует определённое расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности (происходит изменение электронных структур взаимодействующих атомов).
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2189; Нарушение авторских прав?; Мы поможем в написании вашей работы!