
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кремниевые кислоты
|
|
|
|
Азот
BiH3 висмутин
SbH3 стибин
AsH3 арсин
PH3 фосфин
NH3 аммиак
AsH3, SbH3 газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты.
В кислородных соединениях для элементов VА группы наиболее характерны степени окисления +3 и +5. Для висмута более характерна степень окисления +3.
Все элементы VА группы имеют оксиды типа Э2О5 и гидроксиды НЭО3 или Н3ЭО4, которые обладают кислотными свойствами. Кроме того для них характерны оксиды типа Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3, у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы – амфотерные, а у висмута проявляют основной характер.
Характерно также образование галидов типа ЭГ3 (тригалиды), которые (за исключением NF3) гидролизуются по схеме:
ЭГ3 + 3Н2О = Н3ЭО3 + 3НГ
ЭCl3 + H2O = H3ЭО3 + 3НCl
но в присутствии галоводородной кислоты галиды сурьмы и висмута гидролизуются с образованием галоксидов, например
SbCl3 + H2O = SbOCl + 2HCl
Группу SbO+ называют антимонилом, а соединение SbOCl – хлоридом антимонила. Для фосфора, мышьяка и сурьмы известны пентафториды ЭF5, а для фосфора и сурьмы пентахлориды ЭCl5.
Мышьяк и сурьма имеют ряд аллотропных форм. Наиболее устойчивые металлические формы серого (As) и серебристо-белого (Sb) цвета. Это хрупкие вещества, легко превращаемые в порошок. Висмут – металл серебристо-белого цвета с едва заметным розовым оттенком.
Соединения As, Sb, Bi ядовиты. Особо опасны соединения As3+ (AsH3- арсин).
(от греч. azoos - безжизненный, лат. Nitrogenium), N, химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса.
Историческая справка. Соединения Азота - селитра, азотная кислота, аммиак - были известны задолго до получения Азота в свободном состоянии. В 1772 году Д. Резерфорд, сжигая фосфор и других вещества в стеклянном колоколе, показал, что остающийся после сгорания газ, названный им "удушливым воздухом", не поддерживает дыхания и горения. В 1787 году А. Лавуазье установил, что "жизненный" и "удушливый" газы, входящие в состав воздуха, это простые вещества, и предложил название "Азот". В 1784 году Г. Кавендиш показал, что Азот входит в состав селитры; отсюда и происходит латинское название Азот (от позднелатинского nitrum - селитра и греческого gennao - рождаю, произвожу), предложенное в 1790 году Ж. А. Шапталем. К началу 19 века были выяснены химическая инертность Азота в свободном состоянии и исключительная роль его в соединениях с других элементами в качестве связанного азота. С тех пор "связывание" Азота воздуха стало одной из важнейших технических проблем химии.
Распространение Азота в природе. Азот - один из самых распространенных элементов на Земле, причем основная его масса (около 4·1015 т) сосредоточена в свободном состоянии в атмосфере. В воздухе свободный Азот (в виде молекул N2) составляет 78,09% по объему (или 75,6% по массе), не считая незначительных примесей его в виде аммиака и оксидов. Среднее содержание Азота в литосфере 1,9·10-3% по массе. Природные соединения Азота - хлористый аммоний NH4Cl и различные нитраты. Крупные скопления селитры характерны для сухого пустынного климата (Чили, Средняя Азия). Долгое время селитры были главным поставщиком Азота для промышленности (сейчас основные значение для связывания Азота имеет промышленный синтез аммиака из Азота воздуха и водорода). Небольшие количества связанного Азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1%) и в живых организмах (0,3%).
Хотя название "Азот" означает "не поддерживающий жизни", на самом деле это - необходимый для жизнедеятельности элемент. В белке животных и человека содержится 16-17% Азота. В организмах плотоядных животных белок образуется за счет потребляемых белковых веществ, имеющихся в организмах травоядных животных и в растениях. Растения синтезируют белок, усваивая содержащиеся в почве азотистые вещества, главным образом неорганические. Значит, количества Азот поступают в почву благодаря азотфиксирующим микроорганизмам, способным переводить свободный Азот воздуха в соединения Азота.

Фо́сфор
(от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Один из распространённых элементовземной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л[5]. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Растворимость фосфатов
в воде резко падает с увеличением числа замещенных металлом атомов водорода. Трехзамещенные фосфаты практически не растворяются и поэтому служат основой защитной пленки. [ 1 ]
Растворимость фосфата алюминия в растворах, содержащих избыток фосфата, изучали, определяя концентрацию алюминия в растворе в зависимости от рН после перемешивания исследуемой системы 24 ч и последующего отделения твердой фазы фильтрованием через мембранные фильтры. Результаты исследований показаны на рис. 4.6. Из-за ограниченной растворимости фосфата в щелочных средах растворы, содержащие 0 5 и 1 М фосфата, при рН9 были пересыщенными. В основном растворимость фосфата алюминия сильно зависела от концентрации как фосфата, так и иона водорода. В области больших значений рН растворимость фосфата алюминия возрастает с увеличением исходной концентрации фосфата. Кривые растворимости сливаются в одну прямую (см. рис. 4.6) при высоких значениях рН, что позволяет предположить образование частиц основного фосфата алюминия. [ 2 ]
Растворимость фосфатов алюминия в фосфорной кислоте значительно выше, чем фосфатов железа43 - 45; количество окиси алюминия в фосфатном сырье большей частью меньше, чем окислов железа. По этим причинам в условиях производства фосфорной кислоты находящиеся в ней фосфаты алюминия обычно не осаждаются. [ 3 ]
Растворимость фосфатов алюминия в фосфорной кислоте значительно выше, чем фосфатов железа 54 - 5б; количество окиси алюминия в фосфатном сырье большей частью меньше, чем окислов железа. По этим причинам в условиях производства фосфорной кислоты находящиеся в ней фосфаты алюминия обычно не осаждаются. [ 4 ]
Растворимость фосфата бария Ваз (РО4) з, соли кислоты средней силы, в более слабой уксусной кислоте становится понятной, если сравнить величины констант последовательной диссоциации фосфорной кислоты с константой диссоциации уксусной кислоты. Следовательно, HsPCV и HPOi менее диссоциируют, чем уксусная кислота, водородные ионы последней будут подавлять их диссоциацию. Когда ВазСРСХЬ соприкасается с водой, образуется небольшое количество Р04 - иояов, но в присутствии уксусной кислоты образуются ионы Н2РС4 и HPO-i и, таким образом, из раствора исчезают РО4 - ионы, вследствие чего произведение концентрации ионов фосфата бария делается меньше его произведения растворимости и поэтому будет происходить его дальнейшее растворение в уксусной кислоте. [ 5 ]
Растворимость фосфатов щелочных металлов возрастает с увеличением атомного веса катиона. Наиболее растворимы фосфаты рубидия и цезия. [ 6 ]
Растворимость фосфата бария Ваз (РО4) з, соли кислоты средней силы, в более слабой уксусной кислоте становится понятной, если сравнить величины констант последовательной диссоциации фосфорной кислоты с константой диссоциации уксусной кислоты. Следовательно, HsPCV и HPOi менее диссоциируют, чем уксусная кислота, водородные ионы последней - будут подавлять их диссоциацию. Когда Ваз (Р (ХЬ соприкасается с водой, образуется небольшое количество Р04 - иояов, но в присутствии уксусной кислоты образуются ионы HsPO-i и HPO-i и, таким образом, из раствора исчезают РО4 - ионы, вследствие чего произведение концентрации ионов фосфата бария делается меньше его произведения растворимости и поэтому будет происходить его дальнейшее растворение в уксусной кислоте. [ 7 ]
Растворимость фосфатов щелочных металлов возрастает с увеличением атомного веса катиона. Наиболее растворимы фосфаты рубидия и цезия. [ 8 ]
Малой растворимостью фосфата даже в сильнокислых растворах цирконий и гафний отличаются от всех других металлов. [ 9 ]
Мала растворимость фосфатов позволяет осаждать цирконий из сильнокислых растворов и таким образом отделять цирконий от многих других элементов. Фосфат циркония пригоден для гравиметрического определения циркония. При прокаливании фосфатов циркония и гафния образуются пирофосфаты Zr (Hf) P2O7, удовлетворяющие требованиям к весовым формам (см. стр. Меньшая растворимость фосфата гафния по сравнению с фосфатом циркония позволяет осуществлять фракционное разделение циркония и гафния (см. стр. Фосфаты циркония могут быть использованы как ядг. [ 10 ]
Вследствие растворимости фосфата лития в промывных водах необходимо выпаривание их досуха и вторичное выделение Li. Более быстрым является осаждение фосфатами четвертичных аммониевых оснований (тетраметиламмония или холина) к присутствии 50 % 2-пропа-нола или этанола для понижения растворимости LinPOi [92], так как при этом не требуется выпаривания досуха для отделения осадка. [ 11 ]
Повышение растворимости фосфата висмута в присутствии ионов хлора, согласно исследованиям Енсена [4], объясняется комплексообразованием. По данным этого автора, растворимость фосфата висмута в присутствии ионов хлора, водорода и фосфорной кислоты приблизительно пропорциональна 3 - й степени концентрации водородных ионов и не зависит от концентрации фосфорной кислоты. [ 12 ]
Увеличение растворимости фосфата плутония (IV) с ростом концентрации Н3РО4 в азотнокислых растворах было интерпретировано Кингом [ 3, гл. [ 13 ]
Повышение растворимости фосфата висмута в присутствии ионов хлора, согласно исследованиям Енсена [4], объясняется комплексообразованием. По данным этого автора, растворимость фосфата висмута в присутствии ионов хлора, водорода и фосфорной кислоты приблизительно пропорциональна 3 - й степени концентрации водородных ионов и не зависит от концентрации фосфорной кислоты. [ 14 ]
Практическое значение соединений фосфора.

Общая характеристика элементов IVA группы.
Нахождение в природе. Валентности и степени окисления.
Углерод. Аллотропия углерода. Способность углерода образовывать длинные цепи и циклы. Соединения с отрицательной степенью окисления. Метан. Природные газы. Карбиды. Соединения углерода (IV). Анализ свойств диоксида углерода (углекислый газ). Угольная кислота и ее производные. Соединения углерода с азотом. Цианамид кальция CaCN2. Циан, синильная кислота. Цианиды. Роданиды. Комплексные соединения.
Получение и свойства оксида углерода (II). Карбонилы переходных металлов. Щавелевая кислота. Оксалаты. Их получение и свойства.
Кремний. Распространенность в природе и роль соединений кремния. Получение и свойства силанов. Оксид кремния (IV) и кремниевые кислоты. Свойства кремниевых кислот. Силикаты. Особенности гидролиза силикатов и галогенидов кремния.
Подгруппа германия. Германий. Олово. Свинец. Физико-химические свойства. Важнейшие производные германия, олова и свинца. Сравнительная характеристика кислотно-основных свойств оксидов и гидроксидов элементов со степенью окисления (+2) и (+4). Окислительно-восстановительные свойства соединений элементов со степенью окисления (+2) и (+4).
Углерод,С
По богатству и многообразию своих производных углерод оставляет далеко позади все остальные элементы, вместе взятые: в то время как химических соединений, не содержащих С в своем составе, известно лишь несколько десятков тысяч, число изученных углеродистых соединений исчисляется сотнями тысяч Это обстоятельство заставляет выделить детальное изучение химии углерода в самостоятельную область, называемую обычно органической химией. Многообразие соединений углерода по сравнению с другими элементами обусловлено некоторыми особенностями самих углеродных атомов. Важнейшей из них является способность к образованию прочных связей друг с другом. Благодаря этому молекулы, содержащие в своем составе цепи углеродных атомов, являются при обычных условиях вполне устойчивыми, тогда как молекулы с подобным же цепеобразным накоплением атомов других элементов в подавляющем большинстве случаев очень непрочны. Например, для кислорода максимальная известная длина цепи равна двум атомам, причем содержащие ее соединения (перекись водорода и ее производные) малоустойчивы, тогда как для углерода было получено вполне устойчивое соединение! имеющее в своем составе цепь из 100 углеродных атомов. Изучение содержащих углеродные цепи молекул при помощи рентгеновских лучей показало, что атомы углерода в подобных цепях располагаются не на одной прямой, а по зигзагу (рис. 140). Существование последнего обусловлено тем, что четыре валентности углеродного атома определенным образом направлены по отношению друг к другу: их взаимное расположение отвечает линиям, идущим из центра тетраэдра (рис. 124) к его углам. Цепи углеродных атомов в молекулах органических веществ могут быть не только открытыми, но и замкнутыми Производные первого типа называются соединениями с открытой цепью, второго –циклически ми. Вследствие образования устойчивых цепей соединения углерода одного и того же. типа насчитываются не единицами (как у других элементов), а десятками и сотнями. Например, для кислорода известны только два водородных соединения (H2 O и Н2 О2), тогда как в случае углерода, кроме метана (СН4) могут быть получены этан (С2 Н6), пропан (C3 H8), бутан (С4 Н10) и т. д. Как видно из формул приведенных углеводородов, все они образуют ряд, s котором каждый последующий член может быть произведен от предыдущего усложнением его состава на одну группу СН2. Подобные ряды соединений называют гомологическими и различают их друг от друга по первому члену. Так, приведенные выше углеводороды принадлежат к гомологическому ряду метана, или, иначе, являются гомологами метана. Каждый гомологический ряд может быть–выражен одной общей формулой. В рассматриваемом случае формула имеет вид Cn H2n+2. Зная ее, легко найти химический состав любого члена данного ряда. Например, гомолог метана с 7 атомами углерода будет иметь состав C7 H7·2+2 или С7 Н16.
Распространение Углерода в природе.
Среднее содержание Углерода в земной коре 2,3·10-2% по массе (1·10-2 в ультраосновных, 1·10-2 - в основных, 2·10-2 - в средних, 3·10-2 - в кислых горных породах). Углерод накапливается в верхней части земной коры (биосфере): в живом веществе 18% Углерода, древесине 50%, каменном угле 80%, нефти 85%, антраците 96%. Значительная часть Углерода литосферы сосредоточена в известняках и доломитах.
Число собственных минералов Углерода - 112; исключительно велико число органических соединений Углерода - углеводородов и их производных.
С накоплением Углерода в земной коре связано накопление и многих других элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов, и т. д. Большую геохимическую роль в земной коре играют СО2 и угольная кислота. Огромное количество СО2выделяется при вулканизме - в истории Земли это был основные источник Углерода для биосферы.
По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает Углерод из недр (уголь, нефть, природный газ), так как эти ископаемые - основной источник энергии.
Огромное геохимическое значение имеет круговорот Углерода.
Углерод широко распространен также в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислород
карбонатное равновесие
Интенсивный водоотбор создает не только гидродинамическую, но и температурную и гидрохимическую аномалии, обусловленные вовлечением в воронку депрессии грунтовых, речных и техногенных вод часто высокоагрессивных, имеющих иной химический состав и температуры по сравнению с водами эксплуатируемого водоносного горизонта. Смешение вод, даже ранее не агрессивных, различного состава и температуры может привести к нарушениюкарбонатного равновесия. Процесс усиливается при привлечении агрессивных речных и техногенных вод, при резком возрастании скоростей фильтрации и при повышении температур. [ 1 ]
Лабораторные исследования показали, что при контактировании пресной и пластовой вод осадок не выпадает. Однако процесс фильтрации закачиваемой воды в пласте, как будет показано ниже, сопровождается выщелачиванием породы пласта и нарушениемкарбонатного равновесия пластовой системы, что в сочетании с некоторыми другими факторами приводит к отложению карбонатных солей в промысловом оборудовании. [ 2 ]
Анализ результатов исследований показывает, что при движении по пласту пластовых вод в зависимости от положения скважины на структуре, литологического состава пород, физико-химических свойств пластовых и закачиваемых вод изменяются их физико-химические свойства. Возникновение процесса соле-образования связано с нарушением равновесного состояния системы нефть - вода - газ; в процессе раз-газирования наблюдаются выделение углекислого газа и нарушениекарбонатного равновесия системы. [ 3 ]
Смеси вод в соотношениях 1: 3, 1: 1, 3: 1 были проанализированы после 12 сут стояния в закрытых сосудах. Сопоставление (рассчитанного согласно пропорциям смешения) содержания бикарбоната кальция (см. рисунок, а) с аналитически определенным (рисунок, б) показало значительное нарушениекарбонатного равновесия в смесях, содержащих до 50 % об. воды гидрокарбонатнонатриевого типа. [ 4 ]
Из уравнения основного карбонатного равновесия следует, что воды с одинаковым содержанием свободной угольной кислоты, но с различной концентрацией гидрокарбонатов будут проявлять неодинаковую активность по отношению к карбонату кальция. Поэтому маломинерализованные воды вследствие избытка свободной угольной кислоты могут проявлять агрессивные свойства по отношению к бетону. Нарушениемосновного карбонатного равновесия объясняется и образование карбонатной накипи при нагревании воды. С повышением температуры растворимость диоксида углерода в воде уменьшается и поэтому наблюдается смещение карбонатного равновесия в направлении образования свободной угольной кислоты и карбонат-ионов при разложении гидрокарбонатов. С ионами Са2 карбонат-ионы образуют карбонат кальция, растворимость которого понижается с повышением температуры. [ 5 ]
– соединения оксида кремния с водой, очень слабые нерастворимые кислоты. Соотношение оксида кремния и воды различно, общая формула nSiO2·mH2O, кислоты легко переходят друг в друга. В водных растворах доказано существование ортокремниевой H4SiO4, пирокремниевой H6Si2O7, метакремниевой H2SiO3 и дикремниевой H2Si2O5 кислот.
Их нельзя получить в чистом виде.
Соли кремниевой кислоты – силикаты. Обычно они нерастворимы в воде, исключения составляют силикаты натрия и калия, их называют «жидким стеклом». Силикаты широко распространены в природе. Свойства силикатов различны в зависимости от их состава и строения, очень часто они имеют красивую окраску, некоторые из них используются в ювелирном деле (гранат, топаз, изумруд).
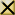
Силикаты широко распространены в природе. Они имеют различный состав и строение. Практически все силикаты содержат структурную единицу – кремнийкислородный тетраэдр SiO4. В структуре силикатов атомы кремния могут замещаться на атомы алюминия, в этом случае образуются алюмосиликаты. По строению силикаты и алюмосиликаты делятся на следующие классы: островные, цепочечные, ленточные, слоистые и каркасные.
Стекло – тоже силикат. Состав обычного оконного стекла: Na2O·CaO·6SiO2. Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 = Na2O·CaO·6SiO2 + 2CO2.
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато–лиловый.
металлы положение в период. системе
составляют большую часть химических элементов. Каждый период периодической системы (кроме 1-го) химических элементов начинается с металлов, причем с увеличением номера периода их становится все больше. Если во 2-м периоде металлов всего 2 (литий и бериллий), в 3-м — 3 (натрий, магний, алюминий), то уже в 4-м — 13, а в 7-м — 29.
Атомы металлов имеют сходство в строении внешнего электронного слоя, который образован небольшим числом электронов (в основном не больше трех).
Это утверждение можно проиллюстрировать на примерах Na, алюминия А1 и цинка Zn. Составляя схемы строения атомов, по желанию можно составлять электронные формулы и приводить примеры строения элементов больших периодов, например цинка.
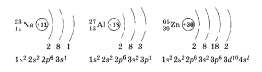
В связи с тем что электроны внешнего слоя атомов металлов слабо связаны с ядром, они могут быть «отданы» другим частицам, что и происходит при химических реакциях:
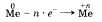
Свойство атомов металлов отдавать электроны явтяется их характерным химическим свойством и свидетельствует о том, что металлы проявляют восстановительные свойства.
При характеристике физических свойств металлов следует отметить их общие свойства: электрическую проводимость, теплопроводность, металлический блеск, пластичность, которые обусловлены единым видом химической связи — металлической, и металлической кристаллической решетки. Их особенностью является наличие свободноперемещаю-щихся обобществленных электронов между ион-атомами, находящимися в узлах кристаллической решетки.
При характеристике химических свойств важно подтвердить вывод о том, что во всех реакциях металлы проявляют свойства восстановителей, и проиллюстрировать это записью уравнений реакции. Особое внимание следует обратить на взаимодействие металлов с кислотами и растворами солей, при этом необходимо обратиться к ряду напряжений металлов (ряд стандартных электродных потенциалов).
Примеры взаимодействия металлов с простыми веществами (неметаллами):
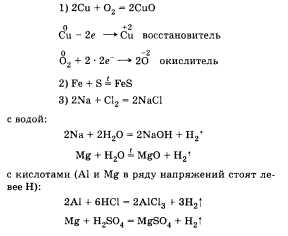
с солями (Zn в ряду напряжений стоит левее Сu): Zn + СuС12 = ZnCl2 + Сu!
Таким образом, несмотря на большое многообразие металлов, все они обладают общими физическими и химическими свойствами, что объясняется сходством в строении атомов и строении простых веществ.
Электронное строение металла
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) вкристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуютразрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, то есть течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Существуют несколько основных способов получения —металлов.
Восстановление:
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем)
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей
СuСl2, — Сu2+ 2Сl
Катод (восстановление): Анод (окисление):
Сu2+ 2е- = Сu0 2Cl - 2е- = Сl°2
Перехо́дные мета́ллы
(перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.[1] В общем виде электронное строение переходных элементов можно представить следующим образом:  . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на
. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на 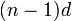 -орбитали. Поскольку числовалентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
-орбитали. Поскольку числовалентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
| Таблица переходных металлов | ||||||||||||||||||||||||||||||
| Группа → Период ↓ | III | IV | V | VI | VII | VIII | I | II | ||||||||||||||||||||||
| 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | |||||||||||||||||||||
| 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | |||||||||||||||||||||
| * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | |||||||||||||||||||||
| ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | |||||||||||||||||||||
| Лантаноиды * | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |||||||||||||||
| Актиноиды ** | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | |||||||||||||||
Минералы переходных элементов
ироксен 
Известковый плагиоклаз 
На Луне распространены также следующие минералы:
Оливин 
Пироксферроит 
Кристобалит и тридимит 
Некоторые менее распространенные лунные минералы тоже содержат  -элементы, например:
-элементы, например:
Ульвошпинель 
Армаколит 
Троилит 
Хромит 
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1045; Нарушение авторских прав?; Мы поможем в написании вашей работы!