
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородная связь
|
|
|
|
Другие свойства
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтены Я. Д. Ван-дер-Ваальсом в 1873 году. Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей.
Пример межмолекулярных водородных связей
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Природа
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H•••BR' различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR'.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H•••[F-H•••F]-).
Свойства
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+ образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
В воде
Механизм Гротгуса
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных Н-связей до 5-6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Водные кластеры
Водородная связь между молекулами воды обозначена чёрными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).
Основная статья: Водный кластер
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:

Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал/моль), что всего на порядок больше, чем характерная энергия теплового движения при температуре 300 К. В то же время энергия ковалентной O-H связи в 200 раз больше тепловой энергии. Таким образом, водородные связи относительно слабы и неустойчивы: предполагается, что они могут легко возникать и исчезать в результате тепловых флуктуаций. Это, в частности, приводит к тому, что вода должна рассматриваться не как «простая», а как «связанная жидкость»: вода представляется как сеть молекул, соединённых водородными связями.
В нуклеиновых кислотах и белках
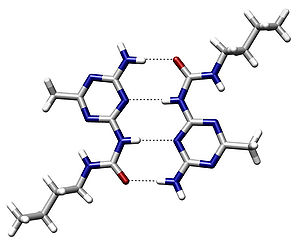
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах, водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК, определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
В полимерах
Много полимеров усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон, где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы) и в многих различных формах в природе, таких как древесина, хлопок и лён.
Кристаллическая структура, расположение атомов кристаллического вещества в пространстве. Наиболее характерное свойство кристаллической структуры - трехмерная периодичность. Обычно, говоря о кристаллической структуре, подразумевают среднее во времени расположение атомных ядер (так называемую статическую модель); более полная информация включает сведения об амплитудах и частотах колебаний атомов (динамическую модель), а также о распределении электронной плотности в межъядерном пространстве. Изучение кристаллической структуры и их связи со свойствами веществ составляет предмет кристаллохимии.
Геом. характеристики кристаллической структуры, данные о распределении электронной плотности, амплитуды колебаний атомов (точнее, среднеквадратичные смещения от положений равновесия) находят с помощью дифракционных методов исследования (рентгеноструктурного анализа, нейтронографии и электронографии кристаллов), частоты колебаний - методами спектроскопии (ИК, комбинац. рассеяния, неупругого рассеяния нейтронов).
По характеру связи между атомами или структурными фрагментами различают ковалентные кристаллы, ионные кристаллы, металлические кристаллы и ван-дер-ваальсовы кристаллы. Последняя группа включает, в частности, молекулярные кристаллы. Это деление (как и деление химической связи на типы) условно, однако типичные представители разных групп резко различаются по свойствам, например по энергии структуры (энергия, необходимая для разъединения твердого тела на отдельные атомы, ионы или молекулы, отнесенная к 1 молю кристаллического вещества).Так, для ковалентных кристаллов SiC энергия структуры 1180 кДж/моль, для ионных NaCl 752 кДж/моль, для металлического Na 108 кДж/моль, для молекулярных кристаллов СН4 10 кДж/моль.
Зависимость свойств веществ от кристаллической структуры делает изучение кристаллическая структура важным в практическом отношении. Так, слоистые кристаллы графита, галогенидов Cd, MoS2 способны легко раскалываться по плоскостям, которые параллельны слоям; на этом свойстве основано использование этих веществ в качестве твердых смазок. Небольшое смещение атомов Ва и Ti из центров координационных полиэдров в кристаллах ВаТiO3 приводит к возникновению у этого вещества сегнетоэлектрических свойств.
Яркий пример зависимости свойств от строения дают цеолиты, кристаллическая структура которых содержат более или менее обширные полости с окнами, образованными в результате сцепления через общие вершины кремнекислородных и алюмокислородных тетраэдров SiO4 и АlО4. В результате кристаллы цеолитов избирательно поглощают более или менее крупные молекулы, их кристаллическая структура способна играть роль "молекулярного сита".
Так, шабазит Na[AlSi2O6].3H2O (в прир. минерале Na частично заменен на Са), в кристаллическая структура которого присутствуют окна из 6 и 8 сцепленных тетраэдров, поглощает молекулы н-октана, но не изооктана, что позволяет выделить из бензина изооктановую фракцию. Структура цеолитов во многом определяет также их каталитические свойства.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 693; Нарушение авторских прав?; Мы поможем в написании вашей работы!