
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электолитическая диссоциация воды.водородный показатель
|
|
|
|
Увеличение [H+] вызывает уменьшение [OH-] и наоборот. При этом никогда ни та ни другая концентрация не будет равна нулю.
Для реакции H+aq+ OH-aq = H2Oж DH = -56 кДж/моль, диссоциация воды процесс эндотермический, поэтому с увеличением температуры KW будет возрастать.
Для характеристики кислотности или щелочности среды можно воспользоваться [H+] или концентрацией [OH-]. В нейтральной среде [H+]=[OH-]= 10-7. В кислой среде [H+]>[OH-] или > 10-7. В щелочной наоборот.
Для упрощения расчетов лучше пользоваться т.н. водороднымпоказателем рН = - lg[H+] или pOH = - lg[OH-].
Очевидно, что рН + pOH = 14
Как изменяется рН? В кислой среде рН<7. В щелочной больше 7. рН 1н соляной кислоты должен быть равен 0. РН 1н щелочи - 14. Может ли он быть меньше 0 или больше 14? Казалось бы рН 10н кислоты будет -1. На самом деле нет, поскольку это уже очень концентрированный раствор и кислота в нем далеко не полностью диссоциирована.
Определение рН растворов. а) С помощью индикаторов. Индикатор - слабая кислота или слабое основание, у которого недиссоциированная и диссоциированная формы имеют разную окраску. Добавление к раствору кислоты или щелочи сдвигает равновесие диссоциации этого электролита и меняется его окраска. б) С помощью рН-метра.
Проблема поддержания постоянного значения рН. Особенно остро стоит в биологических системах. В различных органах живого организма рН поддерживается с точностью до десятых долей. Как это достигается, если постоянно идут какие-то процессы, хотя бы поглощение СО2 из воздуха?
Буферные растворы - растворы, в которых в определенных пределах поддерживается постоянное значение рН при добавлении в них кислоты или щелочи а также при разбавлении.
Рассмотрим раствор, содержащий слабую кислоту (уксусную, например) и ее соль. В растворе происходит полная диссоциация соли и частичная - слабой кислоты
CH3COOH «CH3COO- + H+ (K)
CH3COONa «CH3COO- + Na+ нацело
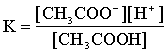
Кислота слабая (К=1.8×10-5). В чистом 0.1М растворе легко подсчитать концентрацию водородных ионов  моль/л. Если к этому раствору добавлен одноименный ион, диссоциация сместилась влево, т.е. [H+] стала еще меньше. Следовательно можно считать, что [CH3COOH] равна концентрации недиссоциированной кислоты Ca, а аниона - концентрации соли (Сs). Тогда:
моль/л. Если к этому раствору добавлен одноименный ион, диссоциация сместилась влево, т.е. [H+] стала еще меньше. Следовательно можно считать, что [CH3COOH] равна концентрации недиссоциированной кислоты Ca, а аниона - концентрации соли (Сs). Тогда:
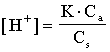
Возьмем ацетатный буфер 0.1:0.1 и 0.1М раствор NaCl.
pH= - lg[H+] = - lg 1.8×10-5= 4.76 для буфера
рН раствора NaCl = 7.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!