
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок заполнения электронами энергии состояния. Составление электронных формул
I. Электронные формулы атомов химических элементов составляют в следующем порядке:
· Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
· Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
· Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
· Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
1. у элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
2. у элементов побочных подгрупп на внешнем уровне обычно два электрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне ноль электронов);
3. число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
II. Порядок заполнения электронами атомных орбиталей определяется:
1.Принципом наименьшей энергии
Шкала энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
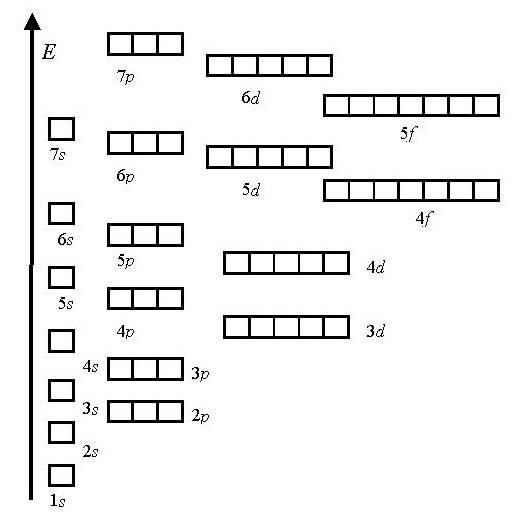
2. Состояние атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.
Этим объясняется «провал» электрона. Так, устойчивому состоянию атома хрома соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4,
т. е. происходит «провал» электрона с 4s-подуровня на 3d-подуровень.
III. Семейства химических элементов.
- Элементы, в атомах которых происходит заполнение электронами s-подуровня внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
- Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III-VIII групп.
- Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
- Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
32.33. определения типа хим связи. причины образования хим связ и
При образовании химической связи происходит перераспределение в пространстве электронных плотностей, первоначально принадлежавших разным атомам. Поскольку наименее прочно связаны с ядром электроны внешнего уровня, то этим электронам принадлежит главная роль в образовании химической связи. Количество химических связей, образованных данным атомом в соединении, называют валентностью. Электроны, принимающие участие в образовании химической связи, называются валентными: у s- и р элементов — это внешние электроны, у d- элементов — внешние (последние) s-электроны и предпоследние d-электроны. С энергетической точки зрения наиболее устойчивым является атом, на внешнем уровне которого содержится максимальное число электронов (2 и 8 электронов). Такой уровень называют завершенным. Завершенные уровни отличаются большой прочностью и характерны для атомов благородных газов, поэтому при обычных условиях они находятся в состоянии химически инертного одноатомного газа.
У атомов других элементов внешние энергетические уровни незавершенные. В процессе хим реакции осуществляется завершение внешних уровней, что достигается либо присоединением, либо отдачей электронов, а также образованием общих электронных пар. Эти способы приводят к образованию двух основных типов связи: ковалентной и ионной. Таким образом, при образовании молекулы каждый атом стремится приобрести устойчивую внешнюю электронную оболочку: либо двухэлектронную (дублет), либо восьми-злектромную (октет). Эта закономерность положена в основу теории образования химической связи. Образование химической связи за счет завершения внешних уровней в образующих связь атомах сопровождается выделением большого количества энергии, то есть возникновение химической связи всегда протекает экзотермически, поскольку оно приводит к появлению новых частиц (молекул), обладающих при обычных условиях большей устойчивостью, а следовательно, они меньшей энергией, чем у исходных. Одним из существенных показателей, определяющих какая связь образуется между атомами, является электроотрицательность, то есть способность атомом притягивать к себе электроны от других атомов. Электроотрицательность атомов элементов изменяется постепенно: в периодах периодической системы слева направо ее значение возрастает а в группах сверху вниз — уменьшается.
Химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар, называется ковалентной.1) Разберем пример образования химической связи между атомами с одинаковой электроотрицательностью, например, молекулы водорода Н2 Образование химической связи в молекуле водорода можно представить в виде двух точек: Н- + -Н -> Н: Н или черточкой, которая символизирует пару электронов: H-H Ковалентная связь, образованная атомами с одинаковой электроотрицательностью называется неполярной. Такую связь образуют двухатомные молекулы, состоящие из атомов одного химического элемента: H 2, Cl 2 и др.2) Образование ковалентной связи между атомами, электроотрицательность которых различается незначительно. Ковалентная связь, образованная атомами с различной электроотрицательностью, называется полярной. При ковалентной полярной связи электронная плотность от общей пары электронов смещена к атому с большей электроотрицательностью. Примерами могут служить молекулы Н2О, NH3, H2S, CH3Cl. Ковалентная (полярная и неполярная) связь в наших примерах образовалась за счет неспаренных электронов связывающихся атомов. Такой механизм образования ковалентной связи называется обменным. Другой механизм образования ковалентной связи — донорно-акцепторный. В этом случае связь возникает за счет двух спаренных электронов одного атома (донора) и свободной орбитали другого атома (акцептор). Хорошо известный пример — образование иона аммония: Н++:NH 3 -> [ Н: NH3 | + <=====> NH4+ акцептор донор ион аммония электронов. При образовании иона аммония электронная пара азота становится общей для атомов N и Н, то есть возникает четвертая связь, которая не отличается от остальных трех. Их изображают одинаково:
Н+ H-N-H НИонная связь возникает между атомами, электроотрицательность которых резко различается Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na ls2 2s2 2p 6 3s1; 17 Cl ls2 2p 6 Зs2 3р5 Как это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня.:Cl + 1е -->.Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение.
Химическая связь, осуществляемая за счет электростатического притяжения между ионами, называется ионной связью. Соединения, образованные путем притяжения ионов называются ионными. Ионные соединения состоят из отдельных молекул только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют. Ионные соединения образуют резко различные по величине электроотрицательности элементы главных подгрупп I и II групп и главных подгрупп VI и VII групп. Ионных соединений сравнительно немного. Например неорганические соли: NH4Cl (ион аммония NH4 + и ион хлора Cl-), а также солеобразные органические соединения: алкоголяты соли карбоновых кислот, соли аминов Неполярная ковалентная связь и ионная связь — два предельных случая распределения электронной плотности. Неполярной связи отвечает равномерное распределение связующего двух электронного облака между одинаковыми атомами. Наоборот, при ионной связи связующие электронное облако практически полностью принадлежит одному из атомов. В большинстве же соединений химические связи оказывают промежуточными между этими видами связи, то есть в них осуществляется полярная ковалентная связь.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу. В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные коны, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ», обеспечивающий связь между атомами металла. Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью. Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов. В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д. Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Водородные связи могут образовываться между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрицательным элементом, имеющим свободную пару электронов(О,F,N). Водородная связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода, и отчасти, донорно-акцепторным взаимодействием. Водородная связь может быть межмолекулярной и внутримолекулярной. Связи 0-Н имеют выраженный полярный характер: Водородная связь гораздо более слабая, чем ионная или ковалентная, но более сильная, чем межмолекулярное взаимодействие. Водородные связи обуславливают некоторые физические свойства веществ (например, высокие температуры кипения). Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, обеспечивая им определенную пространственную структуру (организацию).
|
|
Дата добавления: 2015-04-24; Просмотров: 1602; Нарушение авторских прав?; Мы поможем в написании вашей работы!