
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні поняття та визначення. Хімічна кінетика - розділ хімії, в якому вивчається швидкість перебігу хімічних реакцій
|
|
|
|
ХІМІЧНА КІНЕТИКА ТА РІВНОВАГА
| Хімічна кінетика | - розділ хімії, в якому вивчається швидкість перебігу хімічних реакцій, залежність швидкості від різних факторів і механізми хімічних процесів. |
| Швидкість хімічної реакції (V) | - зміна кількості речовини за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці площі поверхні поділу фаз (для гетерогенних реакцій). |
| Гомогенні реакції | - реакції, які відбуваються в одній фазі. |
| Гетерогенні реакції | - реакції, які відбуваються на межі поділу фаз. |
| Фактори, які визначають швидкість реакції | - природа реагуючих речовин, їхня концентрація, тиск, температура, присутність каталізатора, властивості розчинника (для розчинів), площа поверхні дотику (для гетерогенних процесів). |
| Закон діючих мас | - швидкість хімічної реакції при сталій температурі пропорційна добутку концентрацій (С) реагуючих речовин у степенях, що дорівнюють стехіометричним коефіцієнтам. Для реакції  закон описується кінетичним рівнянням закон описується кінетичним рівнянням  . .
|
| Константа швидкості (k) | - швидкість реакції за умови, що концентрації кожної з реагуючих речовин або їхній добуток дорівнюють 1 моль/л. |
| Правило Вант-Гоффа | - з підвищенням температури на кожні 100С (або 10К) швидкість більшості гомогенних реакцій збільшується у 2-4 рази.
 , де , де
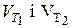 - швидкості реакції при температурах - швидкості реакції при температурах  ;
γ – температурний коефіцієнт реакції, який показує, у скільки разів зростає швидкість реакції з підвищенням температури на 100С (або 10К). ;
γ – температурний коефіцієнт реакції, який показує, у скільки разів зростає швидкість реакції з підвищенням температури на 100С (або 10К).
|
| Оборотні реакції | - реакції, які одночасно відбуваються у двох взаємно протилежних напрямках. |
| Хімічна рівновага | - стан системи, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції. |
| Константа хімічної рівноваги К | - відношення константи швидкості прямої реакції kпр до константи швидкості зворотної реакції kзв, або відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам: 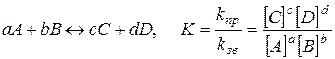 . .
|
| Зміщення хімічної рівноваги | - перехід реакційної системи з одного стану рівноваги в інший. |
| Принцип Ле Шательє | - якщо умови, за яких система знаходиться в рівновазі змінити, рівновага зміщується в напрямку процесів, які протидіють цій зміні. |
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 311; Нарушение авторских прав?; Мы поможем в написании вашей работы!