
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація взаємодій у біополімерах
|
|
|
|
МІЖМОЛЕКУЛЯРНІ ВЗАЄМОДІЇ У БІОПОЛІМЕРАХ
Взаємодії у біополімерах умовно поділяють на сильні та слабкі. До перших слід віднести ковалентні (хімічні або обмінні), кулонівські (іонні) зв'язки, тоді як до других -диполь-дипольні, водневі та гідрофобні зв'язки. У табл. 4.1 наведені основні типи зв'язків і величини енергії взаємодій у біополімерах.
Рис. 4.1. ілюструє характер міжмолекулярних взаємодій для трьох різних областей відстаней між атомами (молекулами). Для відносно малих відстаней (область І) найсуттєвішими являються сильні сили відштовхування, зумовлені ковалентною (обмінною) та кулонівською взаємодіями. Для проміжних відстаней, де досягається мінімум
потенціальної енергії (область II), сили відштовхування та сили притягування, зумовлені ковалентними, електростатичними та іншими силами, виявляються одного порядку. Нарешті, в області III, на відносно великих відстанях починають переважати сили притягання, зумовлені в основному електростатичними мультипольними та диполь-дипольними (індукційними та дисперсійними) силами.
Таблиця 4.1. Міжмолекулярні взаємодії у біополімерах
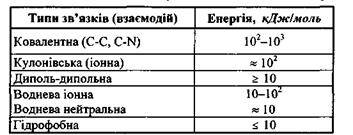
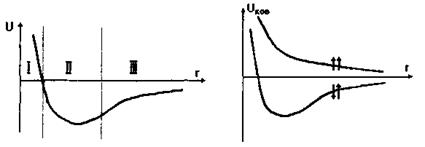
Рис. 4.1. Характер міжмолеку- Рис. 4.2. Залежність енергії ко-
лярних взаємодій U залежно від валентного зв'язку від відстані
відстані г між атомами (молеку- між ядрами атомів, лами).
Сильні ковалентні взаємодії - це взаємодії, зумовлені зовнішніми електронами атомів. Поняття ковалентного зв'язку було запропоновано Л'юїсом у 1916 році, який пов'язав його з утворенням електронної пари, що належить одночасно двом атомам. Квантово-механічний розрахунок ковалентного зв'язку в молекулі водню на підставі рівняння Шредінгера був проведений Гайтлером та Лондоном у 1927 році. Результати розрахунку ковалентного зв'язку у системі, що складається з двох атомів водню, залежно від відстані г між ядрами цих атомів наведені на рис. 4.2.
Видно, що в залежності від орієнтації спінів може мати місце як відштовхування - спіни паралельні (крива 1), так і притягання - спіни антипаралельні (крива 2). В останньому випадку рівноважне положення двох атомів досягається тоді, коли відстань між ними дорівнює 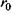 . Ковалентний зв'язок у двох однакових атомах характеризується симетричною щодо обох ядер хвильовою функцією електронів та антисиметричною спіновою хвильовою функцією. Це є неполярний (гомеополярний) зв'язок. Таким чином, можна сказати, що ковалентна (або, як ще кажуть, хімічна чи обмінна) взаємодія зумовлена зв'язком, що створюється між двома однаковими атомами за рахунок спарених електронів з протилежно напрямленими спінами. Коли ж атоми різні, то електронна хмара зміщена у бік більш електровід'ємного атома - такий зв'язок називається полярним (гетерополярним).
. Ковалентний зв'язок у двох однакових атомах характеризується симетричною щодо обох ядер хвильовою функцією електронів та антисиметричною спіновою хвильовою функцією. Це є неполярний (гомеополярний) зв'язок. Таким чином, можна сказати, що ковалентна (або, як ще кажуть, хімічна чи обмінна) взаємодія зумовлена зв'язком, що створюється між двома однаковими атомами за рахунок спарених електронів з протилежно напрямленими спінами. Коли ж атоми різні, то електронна хмара зміщена у бік більш електровід'ємного атома - такий зв'язок називається полярним (гетерополярним).
Цікаво відзначити, що сильна ковалентна (хімічна, обмінна) взаємодія стає зрозумілою лише з позицій квантової механіки. Справді, два електрони не можуть одночасно знаходитися, згідно з уявленнями класичної електродинаміки, що спирається на закон Кулона, в малій області між двома ядрами, скажімо, в молекулі 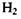 аб
аб  Але стає повністю зрозумілим з погляду квантової механіки, зокрема принципу Паулі, оскільки ці електрони мають антипаралельні спіни.
Але стає повністю зрозумілим з погляду квантової механіки, зокрема принципу Паулі, оскільки ці електрони мають антипаралельні спіни.
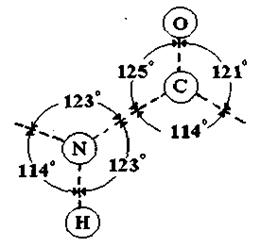
Рис.4.3 Структура пептичного зв’язку за Л.Полінгом
Наступні приклади дають уяву про величину сильних взаємодій: 1) енергія, що необхідна для розриву  зв'язку дорівнює
зв'язку дорівнює 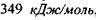 , а для
, а для 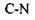 зв'язку відповідно -
зв'язку відповідно -  2) основний елемент зв'язку амінокислотних залишків у білках - це пептидний зв'язок -
2) основний елемент зв'язку амінокислотних залишків у білках - це пептидний зв'язок - 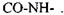 Він має плоску будову, як показав Л. Полінг (див. рис. 4.3). Усі зв'язки між атомами у пептидному зв'язку - ковалентні. Сильні взаємодії визначають ланцюгову будову біополімерів, поєднання між собою монополімерів - амінокислотних залишків, нуклеотидів тощо.
Він має плоску будову, як показав Л. Полінг (див. рис. 4.3). Усі зв'язки між атомами у пептидному зв'язку - ковалентні. Сильні взаємодії визначають ланцюгову будову біополімерів, поєднання між собою монополімерів - амінокислотних залишків, нуклеотидів тощо.
Іонні взаємодії. Сили взаємодії між іонами зумовлені законом Кулона. Енергія іон-іонної взаємодії має такий вигляд:
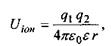 (6.1)
(6.1)
де 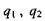 - заряди іонів;
- заряди іонів; 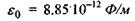 - електрична
- електрична
стала; 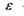 - діелектрична проникність середовища; г -відстань між іонами. Іонні зв'язки утворюються між іоногенними групами у білках, між фосфатними групами в нуклеїнових кислотах і катіонами. Так, аніонами є кислотні залишки - глутамін Глу, тирозин Тир тощо, тоді як в ролі катіонів виступають основні залишки - лізин Ліз, аргінін Apr, гістидин Гіс тощо. Величина іон-іонної взаємодії має той самий порядок, як і ковалентна взаємодія, тобто сотні
- діелектрична проникність середовища; г -відстань між іонами. Іонні зв'язки утворюються між іоногенними групами у білках, між фосфатними групами в нуклеїнових кислотах і катіонами. Так, аніонами є кислотні залишки - глутамін Глу, тирозин Тир тощо, тоді як в ролі катіонів виступають основні залишки - лізин Ліз, аргінін Apr, гістидин Гіс тощо. Величина іон-іонної взаємодії має той самий порядок, як і ковалентна взаємодія, тобто сотні 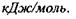
Електростатичні (іон-дипольні та інші мультипольні) взаємодії. Біомолекули не могли б функціонувати, якби, окрім сильних зв'язків усередині біомолекул, не існували б невалентні зв'язки, більш слабкі сили. Слабкі взаємодії - це взаємодії всередині клітин і їх органоїдів, це взаємодія між білками та ліпідами, вуглеводами, нуклеїновими кислотами. Слабкі взаємодії спонукають до рухомих, нежорстких конформацій, що необхідні для функціонування біоорганізмів. Розглянемо основні види відносно слабких взаємодій у біологічних системах.
Іон-дипольні взаємодії - це взаємодії між іонами та полярними групами молекул. Як відомо, полярними молекулами (групами) називаються молекули, що володіють дипольним моментом, котрий у відсутності
зовнішнього електричного поля не дорівнює нулю. Потенціал іон-дипольної взаємодії залежить від заряду іона 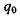 і дипольного моменту
і дипольного моменту  полярної групи відповідно до формули
полярної групи відповідно до формули
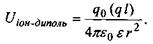 (4.2)
(4.2)
Пояснимо, звідки виникає подібна залежність 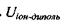 від відстані. В загальному випадку потенціал поля, який утворює система зарядів на відстанях, більших порівняно з розмірами системи, може бути поданий у вигляді ряду по потенціалах мультиполів (зарядів-монополів, диполів, квадруполів тощо). За принципом суперпозиції для загального потенціалу такої системи зарядів маємо
від відстані. В загальному випадку потенціал поля, який утворює система зарядів на відстанях, більших порівняно з розмірами системи, може бути поданий у вигляді ряду по потенціалах мультиполів (зарядів-монополів, диполів, квадруполів тощо). За принципом суперпозиції для загального потенціалу такої системи зарядів маємо
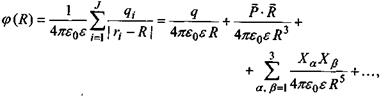
де 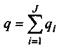 - повний заряд систем;
- повний заряд систем;
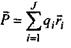 - вектор дипольного моменту;
- вектор дипольного моменту;
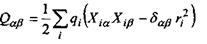 - тензор квадрупольного моменту, в якому використане позначення для символу Крон екера
- тензор квадрупольного моменту, в якому використане позначення для символу Крон екера 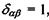 якщо
якщо 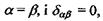 якщо
якщо 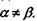
Виявляється, що потенціальна енергія взаємодії заряду 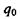 в точці
в точці 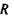 з системою зарядів (рис. 4.4), що утворюють в точці
з системою зарядів (рис. 4.4), що утворюють в точці 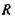 потенціал
потенціал 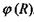 , дається таким виразом:
, дається таким виразом:
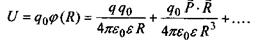
Другий доданок у цій формулі саме й відповідає потенціалу іон-дипольної взаємодії, що визначається формулою (6.2). Якщо у точці 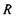 знаходиться не один заряд
знаходиться не один заряд 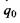 , а система зарядів, то для них можна записати також формулу для потенціалу у вигляді ряду по мультиполях. Отже, має місце мультиполь-мультипольна взаємодія двох систем зарядів, що входять до складу, наприклад, двох біомакромолекул або двох груп певної біомакромолекули.
, а система зарядів, то для них можна записати також формулу для потенціалу у вигляді ряду по мультиполях. Отже, має місце мультиполь-мультипольна взаємодія двох систем зарядів, що входять до складу, наприклад, двох біомакромолекул або двох груп певної біомакромолекули.
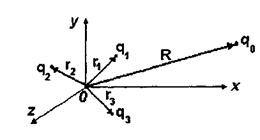
Рис. 4.4. Взаємодія заряду q з системою зарядів.
Залежність потенціалів взаємодії між мультиполями від відстані наведена у табл. 4.2. У принципі існують більш високі мультипольні взаємодії, а саме: між октуполями (груп з восьми зарядів), гексадекуполями (груп з 16 зарядів) тощо.
Таблиця6.2. Потенціали взаємодії мультиполів

Диполь-дипольна взаємодія - взаємодія між диполями молекул або полярними групами молекул. Існує три типи диполь-дипольних взаємодій:
1. Орієнтаційні взаємодії.
2. Індукційні взаємодії.
3. Дисперсійні (Ван-дер-Ваальсівські) взаємодії.
Орієнтаційна диполь-дипольна взаємодія. Формула для потенціалу цієї взаємодії має такий вигляд:
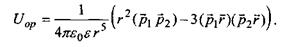 (4.3)
(4.3)
Якщо два диполі зорієнтовані паралельно один до одного (це, зокрема, має місце при низьких температурах чи в сильному електричному полі), то
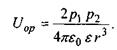
Якщо ж теплова енергія кТ більша за  то тепловий рух руйнує переважну орієнтацію і тоді усереднення за орієнтацією, як показали Рейнганум та Кеєзом, дає результат, відмінний від нуля, тільки для величини усередненої диполь-дипольної взаємодії
то тепловий рух руйнує переважну орієнтацію і тоді усереднення за орієнтацією, як показали Рейнганум та Кеєзом, дає результат, відмінний від нуля, тільки для величини усередненої диполь-дипольної взаємодії
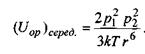 (4.4)
(4.4)
Видно, що ця взаємодія обернено пропорційна температурі Τ і шостому степеню відстані між диполями.
Індукційна диполь-дипольна взаємодія. Ця взаємодія викликана тим, що сталий диполь однієї молекули індукує в іншій молекулі чи групі молекул дипольний момент. Індукований електричним полем Ε дипольний момент дорівнює 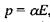 де
де 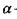 - поляризовність молекули. Напруженість Ε електричного поля, що створюється сталим диполем на відстані
- поляризовність молекули. Напруженість Ε електричного поля, що створюється сталим диполем на відстані 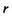 від нього, де знаходиться молекула (група
від нього, де знаходиться молекула (група 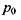 молекул) з індукованим диполем
молекул) з індукованим диполем 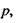 має вигляд
має вигляд
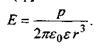
Відповідно енергія індукційної взаємодії є такою:
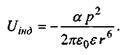 (4.5)
(4.5)
Таким чином, індукційна взаємодія пропорційна 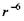 і не залежить від
і не залежить від 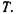 Теорія індукційних диполь-дипольних взаємодій була створена Дебаєм (1920 р.) і Фалькенхагеном (1922 р.).
Теорія індукційних диполь-дипольних взаємодій була створена Дебаєм (1920 р.) і Фалькенхагеном (1922 р.).
Дисперсійні (Ван-дер-Ваальсівські) взаємодії. Ці взаємодії визначають внутрішньо - та міжмолекулярні взаємодії атомних груп і молекул, насичених валентними зв'язками. Вони не залежать від зарядів 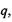 дипольних
дипольних 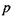 і квадрупольних
і квадрупольних 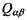 моментів. Зокрема, ці взаємодії відповідають за існування молекулярних кристалів. Ще одна назва дисперсійних взаємодій - Ван-дер-Ваальсівські взаємодії пов'язані з тією важливою обставиною, що вони визначають поправку на тиск у рівнянні стану Ван-дер-Ваальса для реальних газів.
моментів. Зокрема, ці взаємодії відповідають за існування молекулярних кристалів. Ще одна назва дисперсійних взаємодій - Ван-дер-Ваальсівські взаємодії пов'язані з тією важливою обставиною, що вони визначають поправку на тиск у рівнянні стану Ван-дер-Ваальса для реальних газів.
Дисперсійні сили мають квантовий характер. Теорія дисперсійних сил була створена для частинного випадку в 1927 р. Вантоле, а для загального випадку в 1930 році Лондоном. У 1948 році було враховано запізнення дисперсійної взаємодії на великих відстанях, тобто той зрозумілий факт, що будь-яка взаємодія повинна поширюватися у просторі із скінченою швидкістю. Це зробили Казимір і Польдер, які показали, що енергія міжмолекулярної дисперсійної взаємодії обернено пропорційна відстані між молекулами в степені 7, тобто 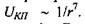 У 1955 році Є. М. Ліфшиц створив загальну теорію Ван-дер-Ваальсівських сил між макроскопічними тілами.
У 1955 році Є. М. Ліфшиц створив загальну теорію Ван-дер-Ваальсівських сил між макроскопічними тілами.
Формула Лондона для дисперсійних (Ван-дер-Ваальсівських) сил отримується при розв'язанні рівняння Шре-дінгера за допомогою так званої теорії збурень. її суть полягає у врахуванні миттєвого значення електростатичної енергії взаємно індукованих диполів двох молекул з наступним усередненням по їх орієнтаціях. Формула Лондона є така:
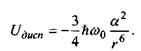 (4.6)
(4.6)
Тут 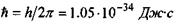 - стала Планка, поділена на
- стала Планка, поділена на  - поляризовність та власна частота гармонічних осциляторів, за допомогою яких можна описати рух електронів у атомі.
- поляризовність та власна частота гармонічних осциляторів, за допомогою яких можна описати рух електронів у атомі.
Величина енергії дисперсійних (Ван-дер-Ваальсівських) взаємодій має порядок кількох 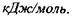 Такий самий порядок має енергія випаровування рідин.
Такий самий порядок має енергія випаровування рідин.
Гідрофобні взаємодії. Біополімери - білки і нуклеїнові кислоти - знаходяться у водному середовищі. Між молекулами води і неполярними атомними групами діють сили відштовхування - гідрофобні сили. Це - так званий ентропійний ефект, який пов'язаний з особливостями структури води. Гідрофобні взаємодії відіграють важливу роль у формуванні структури білків, мембран тощо. Так саме завдяки гідрофобним взаємодіям між водним оточенням та "хвостами" фосфоліпідних молекул, які складаються з неполярних залишків жирних кислот, а також гідрофільним взаємодіям, тобто силам притягання, між полярними "головками" фосфоліпідних молекул та молекулами води, що мають постійні диполі, відбувся процес самозбірки - утворення подвійного шару фосфоліпідних молекул. Внаслідок цього еволюційного детермінованого процесу створилися цитоплазматичні мембрани клітин, що представляють собою основні елементи живих систем.
Зупинимося на питанні про структуру білкових молекул більш докладно. Як відомо, первинна структура визначається послідовністю амінокислотних залишків у білковому ланцюгу; вторинна структура - це є спіральна структура білкових молекул і нуклеїнових кислот; третинна структура, пов'язана з утворенням глобул; нарешті, четвертинна структура формується за рахунок об'єднання кількох глобул. Саме дві останні структури (особливо четвертинна) значною мірою існують завдяки гідрофобним взаємодіям.
Утворення структур пов'язане з дією різних сил. Ми вже казали, що єдині сильні сили у білковій глобулі - це ковалентні (хімічні) сили, які утворені, зокрема, дисульфід-ними зв'язками - сірчані місточки 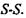 Енергія цих зв'язків дорівнює
Енергія цих зв'язків дорівнює 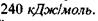 Але якщо б більше не було ніяких сил, то білковий ланцюг був би негнучкий і нагадував, наприклад, каучук. Тому в біополімерах діють також і більш слабкі зв'язки - електростатичні, Ван-дер-Ваальсівсь-кі, водневі та гідрофобні взаємодії.
Але якщо б більше не було ніяких сил, то білковий ланцюг був би негнучкий і нагадував, наприклад, каучук. Тому в біополімерах діють також і більш слабкі зв'язки - електростатичні, Ван-дер-Ваальсівсь-кі, водневі та гідрофобні взаємодії.
Молекули, що мають як полярні, так і неполярні групи, розташовуються у водному середовищі так, що полярні (гідрофільні) групи контактують з водою за рахунок диполь-дипольних сил притягання, а неполярні групи з водного середовища вилучаються через гідрофобну взаємодію.
Серед амінокислотних залишків білків, як зазначалося, існують як полярні (гідрофільні), так і неполярні (гідрофобні) ділянки. Полярні амінокислотні залишки (Асп, Тир, Гіс, Ліз, Apr, Сер, Тре) - гідрофільні. Решта 12 залишків вважаються гідрофобними. Оскільки у білковому ланцюгу є слабкі зв'язки, то він може згорнутися у глобулу, при цьому гідрофобні ділянки будуть всередині, а гідрофільні - ззовні. Якщо концентрації других, тобто гідрофільних, достатньо для покриття поверхні сферичного гідрофобного ядра, то глобула має сферичну форму. Якщо ж їх не вистачає і на поверхні глобули з'являються гідрофобні ділянки, то такі глобули об'єднуються, щоб заховати ці гідрофобні ділянки від водного оточення. Саме такий механізм визначає утворення четвертинної структури - об'єднання між собою кількох глобул. Так, молекула гемоглобіну містить чотири глобули, вірус тютюнової мозаїки - близько 2000 глобул тощо. До питання про форму глобули ми ще повернемося нижче.
Водневі зв'язки. Ряд сполук (спирти, феноли тощо) утворюють стійкі асоціати, які мають певні аномалії в їх фізико-хімічних властивостях (наприклад, підвищення температури кипіння, зменшення міжатомних відстаней та ін.) Виявилося, що подібні властивості мають сполуки, до складу яких входять атом водню в групах типу 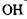 та
та 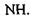 Так виникла ідея про водневі зв'язки. Вперше поняття водневих зв'язків було введено у 1920 році Латимером і Родебургом для пояснення властивостей асоційованих речовин, зокрема води. Атом водню, що міститься в групах
Так виникла ідея про водневі зв'язки. Вперше поняття водневих зв'язків було введено у 1920 році Латимером і Родебургом для пояснення властивостей асоційованих речовин, зокрема води. Атом водню, що міститься в групах 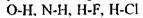 й інколи
й інколи 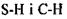 утворює специфічний зв'язок з атомами
утворює специфічний зв'язок з атомами 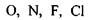 тієї самої або іншої молекули. В цих комплексах, які схематично можна зобразити у вигляді
тієї самої або іншої молекули. В цих комплексах, які схематично можна зобразити у вигляді 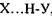 , атом водню відіграє роль мосту між електровід'ємними атомами.
, атом водню відіграє роль мосту між електровід'ємними атомами.
Водневі зв'язки поділяють на внутрішньо молекулярні та міжмолекулярні. Останні, в свою чергу, бувають за силою середні (нейтральні) та міцні (іонні). Нейтральні міжмолекулярні водневі зв'язки існують між нейтральними молекулами і є типовими для розчинів спиртів, карбонових кислот тощо. Такі водневі зв'язки мають енергію в інтервалі 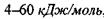 , що приблизно на порядок менше за енергію ковалентних (хімічних) взаємодій. При цьому відстані між атомами
, що приблизно на порядок менше за енергію ковалентних (хімічних) взаємодій. При цьому відстані між атомами 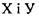 складають до
складають до 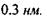 Положення протона Η у водневому зв'язку відповідає мінімуму на кривій потенціальної енергії
Положення протона Η у водневому зв'язку відповідає мінімуму на кривій потенціальної енергії 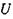 (рис. 4.5)
(рис. 4.5)
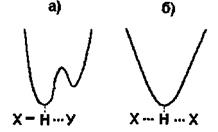
Рис. 4.5. Криві потенціальної енергії взаємодії при наявності водневих зв'язків.
Випадок а характеризує асиметричну криву потенціальної енергії з двома мінімумами. Більша глибина лівого мінімуму означає, що протон знаходиться ближче до атома 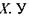 випадку б крива потенціальної енергії є симетричною -вона має один мінімум, що відповідає одній і тій самій відстані між двома однаковими електровід'ємними атомами
випадку б крива потенціальної енергії є симетричною -вона має один мінімум, що відповідає одній і тій самій відстані між двома однаковими електровід'ємними атомами 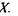
В тих випадках, коли електровід'ємні іони 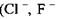 та інші) утворюють водневі зв'язки з молекулами, до складу яких входять групи
та інші) утворюють водневі зв'язки з молекулами, до складу яких входять групи 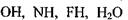 тощо, виникають міцні (іонні) водневі зв'язки з енергією
тощо, виникають міцні (іонні) водневі зв'язки з енергією 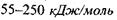 з досить короткими відстанями між атомами
з досить короткими відстанями між атомами 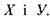 Так, водневий зв'язок у комплексі
Так, водневий зв'язок у комплексі 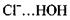 характеризується енергією
характеризується енергією 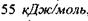 , причому рівноважна відстань
, причому рівноважна відстань 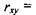
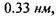 тоді як в комплексі
тоді як в комплексі 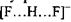 енергія утворення цього комплексу набуває значення
енергія утворення цього комплексу набуває значення 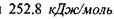 , що є близьким до енергії ковалентних (хімічних) зв'язків. Рівноважна відстань між іонами фтора в комплексі
, що є близьким до енергії ковалентних (хімічних) зв'язків. Рівноважна відстань між іонами фтора в комплексі 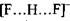 дорівнює
дорівнює 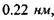 тобто вона в 1.5 раза менша за відстань
тобто вона в 1.5 раза менша за відстань
між іоном хлора і групою 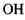 в комплексі
в комплексі 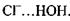
Як вже вказувалося, наявність водневих зв'язків приводить до підвищення температури кипіння (табл. 4.3) та інших фізико-хімічних властивостей речовин.
Таблиця 4.3. Значення температури кипіння при наявності водневих зв 'язків
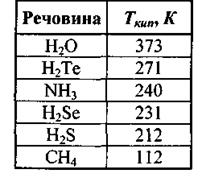
Температура кипіння підвищується у ряді споріднених сполук (наприклад, 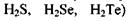 із збільшенням молекулярної ваги.
із збільшенням молекулярної ваги.
Аномально високі температури тверднення і кипіння води - це є також результат утворення водневих зв'язків. Коли б у воді були відсутні водневі зв'язки, то її температура тверднення 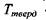 (за теоретичними оцінками) мала бути
(за теоретичними оцінками) мала бути 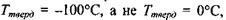 як є насправді. За цими ж оцінками температура кипіння у відсутності водневих зв'язків має бути приблизно
як є насправді. За цими ж оцінками температура кипіння у відсутності водневих зв'язків має бути приблизно 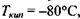 тоді як в дійсності
тоді як в дійсності 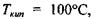 тобто стає на
тобто стає на 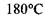 вище саме завдяки наявності водневих зв'язків.
вище саме завдяки наявності водневих зв'язків.
Треба зазначити, що водневі зв'язки значною мірою визначають стійкість вторинної структури білків. Саме внутрішньо молекулярні 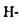 зв'язки між групами поліпептидного ланцюга підтримують
зв'язки між групами поліпептидного ланцюга підтримують  спіральну структуру білка.
спіральну структуру білка.
Прийнято вважати, що потенціальна енергія водневих зв'язків може бути апроксимована сумою двох доданків
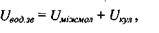 (4.7)
(4.7)
де перший доданок визначає енергію міжмолекулярної взаємодії, а другий - кулонівську енергію іон-іонної взаємодії (див. формулу (4.1)). Звичайно, енергія міжмолекулярної взаємодії задається формулою
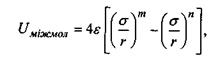 (4.8)
(4.8)
яка відповідно до моделі Леннард-Джонса враховує як сили відштовхування, так і сили притягання (перший і другий доданки в формулі (4.8)). Досить поширеним є таке представлення для потенціалу міжмолекулярної взаємодії, в якому m = 12, n = 6 (так званий потенціал Мі). Зауважимо, що значення n = 6 для потенціалу сил притягання має своє обґрунтування в теорії диполь-дипольної взаємодії (див. формули (4.4)-(4.6) для орієнтаційної, індукційної та дисперсійної взаємодії). Що стосується показника m = 12 для потенціалу сил відштовхування, то він обирається у вигляді m = 2n з міркувань математичної зручності. Для потенціалу Мі коефіцієнт  у формулі (4.8) характеризує глибину потенціальної ями (рис. 4.6), тоді як коефіцієнт у визначає ту відстань між двома молекулами (атомами), де потенціальна енергія сил відштовхування і притягання взаємно врівноважуються.
у формулі (4.8) характеризує глибину потенціальної ями (рис. 4.6), тоді як коефіцієнт у визначає ту відстань між двома молекулами (атомами), де потенціальна енергія сил відштовхування і притягання взаємно врівноважуються.
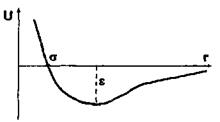
Рис. 4.6. Параметри міжмолекулярної взаємодії у моделі Леннард-Джонса.
На закінчення цього параграфа наведемо підсумкову табл. 4.4, яка містить у собі формули для енергії міжмолекулярної взаємодії залежно від їх типу.
Таблиця 4.4. Формули для енергії взаємодії у біополімерах

|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1521; Нарушение авторских прав?; Мы поможем в написании вашей работы!