
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принципи та правила, які визначають порядок заповнення атомних орбіталей у багатоелектронних атомах
|
|
|
|
Послідовність заповнення електронами атомних орбіталей у багатоелектронних атомах визначають такими принципами та правилами: принципом найменшої енергії, правилами Клечковського, принципом Паулі, правилом Хунда та правилом симетрії.
Основною умовою стабільної електронної конфігурації атома є принцип найменшої енергії, згідно з ним.заповнення електронами атомних орбіталей відбувається у порядку збільшення їх енергії. Тобто кожний наступний електрон займає вільну атомну орбіталь з найменшою енергією, це відповідає його міцному зв'язку з ядром і забезпечує стійкий стан атома.
Принцип мінімуму енергії уточнюється двома правилами Клечковського, які визначають послідовність заповнення електронами енергетичних підрівнів атома. Згідно з першим правилом Клечковського, заповнення електронами енергетичних підрівнів відбувається у порядку послідовного збільшення суми головного та орбітального квантових чисел п + l Ця сума квантових чисел визначає енергію електрона у багатоелектронному атомі.
Згідно з другим правилом Клечковського, для двох атомних орбіталей з однаковою сумою п + l, першою заповнюється електронами атомна орбіталь з меншим значенням головного квантового числа. Для визначення послідовності заповнення електронами атомних орбіталей, розміщених на підрівнях 3s, Зр, 3d, 4s, 4р, обчислюють енергію кожної атомної орбіталі за сумою n + l.
| Підрівень | 3s | 3p | 3d | 4s | 4p |
| Сума | 3+0=3 | 3+1=4 | 3+2=5 | 4+0=0 | 4+1=5 |
| Послідовність заповнення АО |
Користуючись правилами Клечковського, визначають послідовність зростання енергії атомних орбіталей, а також порядок їх заповнення електронами в атомах елементів. Цей ряд, у якому вертикальними лініями розділені періоди, позначені арабськими цифрами, має вигляд:
| 1s | 2s,2p | 3s,3p | 4s,3d,4p | 5s,4d,5p | 6s,4f,5d,6p | 7s,5f,6d,7p |
Принцип Паулі формулюють так: в атомі не може бути двох електронів, у яких усі чотири квантові числа однакові. Фізичний зміст принципа Паулі полягає в тому, що в одній точці атомного простору не можуть одночасно знаходитися два електрони. Оскільки атомну орбіталь описують набором трьох квантових чисел: головним, орбітальним та магнітним, електрони, які на ній знаходяться, відрізняються лише спіновим квантовим числом. Тому на атомній орбіталі знаходяться лише два електрони з протилежними спінами. їх називають електронною парою. Атомну орбіталь позначають коміркою , електрони — стрілками ↑, Сумарний спін двох електронів, які знаходяться на одній атомній орбіталі, дорівнює нулю.
Розподіл електронів у атомах за енергетичними рівнями та підрівнями зображають електронними формулами. У цих формулах цифрою позначають номер відповідного енергетичного рівня (електронного шару), літерою - номер підрівня, індекс праворуч зверху показує число електронів на підрівні.
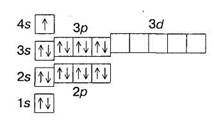
Наприклад, електронна формула калію, елемента І А групи четвертого періоду, атомний номер якого дорівнює 19, має вигляд: 1s2,2s2,2p6,3s2,3p6,4s1.
Згідно з першим правилом Клечковського, у калію заповнюється електроном 4s-орбіталь, для якої n + l = 4 + 0 = 4, а 3d-орбіталі залишаються вільними, тому що для них n+ l = 3 + 2 = 5.
Інколи використовують скорочений запис електронної формули. Наприклад, скорочена електронна формула калію [Аr] 4s1 свідчить, що будова внутрішніх електронних шарів калію ідентична електронній конфігурації благородного газу попереднього періоду — аргону.
Враховуючи, що електрони орієнтовані у просторі вздовж осей х, у, z, електронну формулу калію записують більш докладно: 1s2,2s2,2p2x,2p2y,2p2z,3s2,3p2x,3p2y,3p2z,4s1
Часто будову електронних шарів атома зображають за допомогою квантових комірок — це так звана електронно-графічна формула елемента. Кожну комірку позначають клітинкою, яка означає атомну орбіталь. У клітинках стрілками позначають електрони, причому напрямок стрілки показує напрямок спіна. Вільна комірка означає вільну атомну орбіталь, яка може бути зайнята електронами при збудженні атома.
Електронно-графічна формула калію має вигляд:
Правило Хунда визначає послідовність заповнення електронами атомних орбіталей у межах енергетичного підрівня і формулюють так: електрони заповнюють атомні орбіталі енергетичного підрівня таким чином, щоб абсолютне значення сумарного спіна було максимальним. Тобто на кожну атомну орбіталь підрівня спочатку поступає по одному електрону з однаковим напрямком спіна, а потім по другому з протилежним напрямком спіна. Так, у атома азоту на зовнішньому енергетичному рівні на трьох р-орбіталях розміщені три електрони, по одному на кожній орбіталі, спіни електронів однакові, а сумарний спін дорівнює 3/2. Отже, електронною формулою азоту є 1s22s22p1x2p1y2p1z, а електронно-графічна формула така:
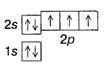
Правило Хунда зумовлене енергетичними вимогами. При його виконанні енергія зв'язку електрона з ядром буде максимальною, її енергія атомної системи мінімальною. Правило Хунда порушується при збудженні атома.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 5319; Нарушение авторских прав?; Мы поможем в написании вашей работы!