
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ПРОГРАМА. (6 год на тиждень, разом 210 год, із них 20 год — резервний час)
|
|
|
|
Й клас
Х І М І Я
(6 год на тиждень, разом 210 год, із них 20 год — резервний час)
| № п/п | Зміст навчального матеріалу | Кількість годин |
| 1. | Вступний інструктаж з ТБ. Інструкція з Т.Б. № 1. ПОВТОРЕННЯ ОСНОВНИХ ВІДОМОСТЕЙ ПРО ОРГАНІЧНІ СПОЛУКИ (3 год). Склад, найважливіших органічних сполук. | |
| 2. | Властивості найважливіших органічних сполук | |
| 3. | Застосуваня найважливіших органічних сполук | |
| 4. | ТЕМА 1. ТЕОРІЯ БУДОВИ ОРГАНІЧНИХ СПОЛУК (5 год.).Короткі відомості з історії становлення і розвитку органічної хімії. Перші синтези органічних речовин. | |
| 5. | Теорія як вища форма наукових знань. Передумови створення теорії хімічної будови органічних сполук. Теорія хімічної будови О.Бутлерова. Залежність властивостей речовин від складу і хімічної будови молекул. | |
| 6. | Ізомерія. Приклади ізомерії неорганічних і органічних речовин. | |
| 7. | Розвиток теоретичних уявлень про будову органічних речовин. | |
| 8. | Основні напрями розвитку теорії будови органічних речовин, її значення. Життя і діяльність О.Бутлерова. Підсумкове оцінювання. | |
| 9. | ТЕМА 2. ВУГЛЕВОДНІ (35 год.). Алкани (парафіни). Метан, його склад, хімічна, електронна, просторова будова молекули. 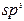 - -гібридизація електронних орбіталей атома Карбону. - -гібридизація електронних орбіталей атома Карбону.
| |
| 10. | Основні характеристики ковалентного зв’язку: довжина, енергія, полярність, просторова напрямленість. Гомолітичне і гетеролітичне розривання ковалентного зв’язку. | |
| 11. | Гомологічний ряд метану, фізичні властивості гомологів, залежність фізичних властивостей від склду і хімічної будови молекул, поширеність у природі. Демонстрації: 1. Визначення якісного складу метану за продуктами згоряння. Інструкція з Т.Б. №1,3,6,10,12. | |
| 12. | Практичні роботи: 1. Розділення й очищення речовин. Перегонка при атмосферного тиску. Перекристалізація. Інструкція з Т.Б. №1,3,6,10-12. | |
| 13. | Просторова будова насичених вуглеводнів. Структурна ізомерія алканів. Демонстрації: 2. Моделі молекул вуглеводнів та галогенопохідних. Інструкція з Т.Б. №1,6. | |
| 14. | Просторова будова насичених вуглеводнів. Структурна ізомерія алканів. Поняття про конформації. Лабораторні досліди: 1. Виготовлення моделей молекул алканів (ізомерів, конформацій). Інструкція з Т.Б. №1,6. | |
| 15. | Систематична номенклатура. | |
| 16. | Поняття про спектральні методи встановленя структури органічних сполук. | |
| 17. | Хімічні властивості алканів: повне і часткове окиснення, хлорування, нітрування, термічний розклад, ізомеризація. Механізм реакції заміщення. | |
| 18. | Хімічні властивості алканів: повне і часткове окиснення, хлорування, нітрування, термічний розклад, ізомеризація. Механізм реакції заміщення. Демонстрації: 3. Відношення насичених вуглеводнів до розчину калій перманганату, лугів, кислот. Інструкція з Т.Б. №1,6,8,10-12. | |
| 19. | Галогенопохідні алканів. Індукційний ефект. Реакції з активними металами, водою, лугами. | |
| 20. | Добування алканів. Застосування алканів та їх галогенопохідних. Практичні роботи: 2. Виявлення Карбону, Гідрогену, Хлору в органічних речовинах. Інструкція з Т.Б. №1,3,6,8-12. | |
| 21. | Добування синтез-газу і водню з метану. | |
| 22. | Циклоалкани (циклопарафіни), їхній склад, будова, ізомерія. Поняття про конформації циклогексану. | |
| 23. | Залежність властивостей циклоалканів від будови циклів. | |
| 24. | Добування і застосування циклоалканів. Проміжне оцінювання. Самостійна робота. | |
| 25. | Алкени. Етен, його склад, хімічна, електронна, просторова будова молекули. 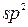 - гібридизація електронних орбіталей атома Карбону. Подвійний карбон-карбоновий зв’язок, - гібридизація електронних орбіталей атома Карбону. Подвійний карбон-карбоновий зв’язок, 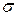 - та - та 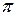 -зв’язки. -зв’язки.
| |
| 26. | Гомологічний ряд етену, загальна формула алкенів. Фізичні властивості. Структурна і просторова (цис-, транс-) зомерія алкенів, номенклатура алкенів. | |
| 27. | Хімічні властивості алкенів: повне і часткове окиснення, приєднання водню, галогенів, гідроген галогенідів, води, полімеризація. Демонстрації: 4. Добування етену. Інструкція з Т.Б. №1,3,6,9-12. | |
| 28. | Хімічні властивості алкенів: повне і часткове окиснення, приєднання водню, галогенів, гідроген галогенідів, води, полімеризація. Демонстрації: 5. Горіння етену, взаємодія з бромною водою, розчином калій перманганату. Інструкція з Т.Б. №1,3,6,8-12. | |
| 29. | Правило В.Марковнікова. Механізм реакції приєднання за подвійним зв’язком. Практичні роботи: 3. Добування етену та досліди з ним. Інструкція з Т.Б. №1,3,6,8-12. | |
| 30. | Розрахункова задачі: 1. Виведення молекулярної формули газуватої речовини. | |
| 31. | Добування та застосування алкенів. | |
| 32. | Алкадієни. Будова молекул алкадієнів зі спряженими зв’язками. Хімічні властивості: окиснення, приєднання, полімеризація. | |
| 33. | Застосування алкадієнів. Природний каучук. Проміжне оцінювання. Самостійна робота. | |
| 34. | Алкіни. Етин, його склад, хімічна, електронна, просторова будова молекули. 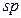 -гібридизація електронних орбіталей атома Карбону. Потрійний карбон-карбоновий зв’язок. -гібридизація електронних орбіталей атома Карбону. Потрійний карбон-карбоновий зв’язок.
| |
| 35. | Гомологічний ряд етину, загальна формула алкінів. Фізичні властивості, ізомерія, номенклатура алкінів. | |
| 36. | Хімічні властивості: повне і часткове окиснення, заміщення, приєднання водню, галогенів, гідроген галогенідів, полімеризація. Демонстрації: 6. Добування етину карбідним способом. 7. Горіння етину, взаємодія з бромною водою, розчином калій перманганату. Інструкція з Т.Б. №1,3,6,8-12. | |
| 37. | Добування та застосування етину. | |
| 38. | Ароматичні вуглеводні (арени). Бензен, його склад, хімічна, електронна, просторова будова молекули, фізичні властивості. Демонстрації: 8. Бензен як розчинник. Інструкція з Т.Б. №1,3,6,8-12. | |
| 39. | Хімічні властивості бензену: окиснення, приєднання, заміщення. Демонстрації: 9. Відношення бензену до розчину калій перманганату. 10. Горіння бензену. 11.Відношення бензену до бромної води. 12. Нітрування бензену. 13. Окиснення толуену. Інструкція з Т.Б. №1,3,6,8-12. | |
| 40. | Гомологи бензену. Взаємний вплив атомів у молекулі (на прикладі толуену). Уявлення про орієнтацію замісників у бензеновому ядрі. | |
| 41. | Добування, застосування бензену. Поняття про хімічні засоби захисту рослин, їх використання у сільському господарстві на основі вимог щодо охорони природи. | |
| 42. | Поняття про вуглеводні з кількома бензеновими ядрами (нафтален, антрацен). | |
| 43. | Взаємозв’язок і взаємоперетворення насичених, ненасичених, ароматичних вуглеводнів. Узагальнення. Різноманітність і особливості біосистем. ПІДСУМКОВИЙ УРОК. Тематичне оцінювання й коригування знань учнів. | |
| 44. | ТЕМА 3. ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ (4 ГОД.).Загальні відомості про гетероциклічні сполуки. | |
| 45. | Гетероцикли як складові частини біологічно активних речовин, барвників, ліків. | |
| 46. | Піридин як представник нітрогеновмісних гетероциклічних сполук. | |
| 47. | Порівняння хімічних властивостей бензену і піридину (повне та часткове окиснення, заміщення, приєднання водню, утворення солей). | |
| 48. | ТЕМА 4. ПРИРОДНІ ДЖЕРЕЛА ВУГЛЕВОДНІВ ТА ЇХ ПЕРЕРОБКА (7 год.). Природний і супутній нафтовий гази, їх склад, використання. | |
| 49. | Нафта. Склад, властивості нафти. Лабораторні досліди: 2. Ознайомлення зі зразками нафтопродуктів і продуктів коксування кам’яного вугілля (колекція). Інструкція з Т.Б. №1,6. | |
| 50. | Фракційна перегонка нафти. Крекінг. Ароматизація нафтопродуктів. Демонстрації: 14. Модель нафтоперегінної установки. Інструкція з Т.Б. №1,6. | |
| 51. | Продукти нафтопереробки, їх застосування. Детонаційна стійкість бензину. | |
| 52. | Кам’яне вугілля, його переробка, продукти переробки. | |
| 53. | Основні види палива та їх значення в енергетиці країни. Проблеми добування рідкого палива з вугілля та інших альтернативних джерел. Лабораторні досліди: 3. Ознайомлення з різними видами палива (колекція). Інструкція з Т.Б. №1,6. | |
| 54. | Охорона навколишнього середовища від забруднень при переробці вуглеводневої сировини та використанні продуктів переробки.Тематичне оцінювання. | |
| 55. | ТЕМА 5. ОКСИГЕНОВМІСНІ СПОЛУКИ (40 ГОД.).Спирти. Насичені одноатомні спирти, їх склад, хімічна будова. Електронна будова функціональної групи. | |
| 56. | Електронна природа водневого зв’язку, його вплив на фізичні властивості спиртів. | |
| 57. | Ізомерія, номенклатура насичених одноатомних спиртів; первинні, вторинні, третинні спирти. Демонстрації: 15. Порівняння властивостей спиртів у гомологічному ряді (розчинність у воді, горіння). Інструкція з Т.Б. №1,3,6,8-12. | |
| 58. | Хімічні властивості спиртів: повне і часткове окиснення, дегідратація, взаємодія з лужними металами. Демонстрації: 16. Взаємодія етанолу з натрієм. Інструкція з Т.Б. №1,3,6-8,10-12. | |
| 59. | Хімічні властивості спиртів: взаємодія з лужними металами, гідроген галогенідами. Демонстрації: 17. Взаємодія етанолу з гідроген бромідом. Інструкція з Т.Б. №1,6,8,9-12. | |
| 60. | Добування та застосування спиртів. Отруйність спиртів, їх згубна дія на організм людини. | |
| 61. | Етиленгліколь і гліцерол. Їхні фізичні та хімічні властивості. Демонстрації: 18. Взаємодія гліцеролу з натрієм. Лабораторні досліди: 4. Розчинність гліцеролу у воді. 5. Взаємодія гліцеролу з купрум(ІІ) гідроксидом. Інструкція з Т.Б. №1,3,6,8-12. | |
| 62. | Фенол, його склад, будова. Фізичні властивості фенолу. Хімічні властивості: взаємодія з натрієм, розчином лугу. Демонстрації: 19. Розчинність фенолу у воді за кімнатної температури та при нагрівання. 20. Добування натрій феноляту. 21. Витіснення фенолу з натрій феноляту дією вуглекислого газу. Інструкція з Т.Б. №1,3,6-12. | |
| 63. | Хімічні властивості: бромною водою, ферум(Ш) хлоридом, нітрування. Демонстрації: 22. Взаємодія фенолу з ферум(ІІІ) хлоридом. Інструкція з Т.Б. №1,3,6,8-12. | |
| 64. | Взаємний вплив атомів у молекулі фенолу. Добування та застосування фенолу. | |
| 65. | Альдегіди і кетони. Склад, хімічна й електронна будова альдегідів і кетонів. Карбонільна група, її особливості. Ізомерія, номенклатура альдегідів і кетонів. | |
| 66. | Фізичні властивості. Хімічні властивості альдегідів і кетонів. Реакції окисненя і відновлення. Поліконденсація метаналю з фенолом. Лабораторні досліди: 6. Окиснення метаналю (етаналю) аргентум(I) оксидом. 7. Окиснення метаналю (етаналю) купрум(ІІ) гідроксидом. Інструкція з Т.Б. №1,3,6,8-12. | |
| 67. | Добування альдегідів і кетонів. Застосування метаналю, етаналю, пропанону. Лабораторні досліди: 8. Окиснення спирту до альдегіду. Інструкція з Т.Б. №1,3,6,8-12. | |
| 68. | Розв’язування розрахункових задач. | |
| 69. | Карбонові кислоти. Насичені одноосновні карбонові кислоти, їх склад, хімічна й електронна будова. Карбоксильна група, її особливості. Фізичні властивості кислот. Номенклатура карбонових кислот. | |
| 70. | Хімічні властивості: електролітична дисоціація, взаємодія з металами, лугами. Демонстрації: 23. Властивості етанової кислоти. Лабораторні досліди: 9. Дія етанової кислоти на індикатори. 10. Взаємодія етанової ї кислоти з магнієм. 11. Взаємодія етанової кислоти з лугом. Інструкція з Т.Б. №1,3,6,8-12. | |
| 71. | Хімічні властивості: солями спиртами. Демонстрації: 24. Взаємодія метанової кислоти з амоніачним розчином аргентум(І) оксиду. Інструкція з Т.Б. №1,3,6,8-12. | |
| 72. | Залежність сили карбонових кислот від їхнього складу і будови. Взаємний вплив карбоксильної і вуглеводневої груп. | |
| 73. | Практичні роботи: 4. Добування, вивчення властивостей етанової кислоти. 1,3,6,8-12. | |
| 74. | Поняття про багатоманітність карбонових кислот (вищі, ненасичені, двоосновні, ароматичні). Застосування і добування карбонових кислот. Лабораторні досліди: 12. Відношення олеїнової кислоти до бромної води і розчину калій перманганату. Інструкція з Т.Б. №1,3,6,8-12. | |
| 75. | Практичні роботи: 5. Розв’язування експериментальних задач. | |
| 76. | Естери. Жири. Мило. Реакція естерифікації. Склад, хімічна будова естерів. Демонстрації: 25. Добування естеру. 26. Ознайомлення зі зразками естерів. Інструкція з Т.Б. №1,3,6,8-12. | |
| 77. | Гідроліз естерів. Застосування естерів. Розв’язування розрахункових задач. | |
| 78. | Практичні роботи: 6. Синтез етилетаноату. Інструкція з Т.Б. №1,3,6,8-12. | |
| 79. | Жири, їх склад, хімічна будова. Гідроліз, гідрування жирів. Лабораторні досліди: 13. Розчинність жирів. 14. Доведення ненасиченого характеру рідких жирів. Інструкція з Т.Б. №1,3,6,8-12. | |
| 80. | Біологічна роль жирів. Мило, його мийна дія. Відомості про синтетичні мийні засоби, їх значення. Лабораторні досліди: 15. Порівняння властивостей мила і синтетичних мийних засобів. Інструкція з Т.Б. № | |
| 81. | Практичні роботи: 7. Гідроліз ацетилсаліцилової кислоти. Інструкція з Т.Б. №1,3,6,8-12. | |
| 82. | Захист природи від забруднення синтетичними мийними засобами. | |
| 83. | Розв’язування розрахункових задач. | |
| 84. | Вуглеводи. Класифікація вуглеводів. Глюкоза, її склад, фізичні властивості й поширеність у природі. Будова глюкози як альдегідоспирту. Циклічна форма глюкози. | |
| 85. | Хімічні властивості глюкози: повне і часткове окиснення, відновлення, взаємодія з гідроксидами металічних елементів, бродіння (спиртове і молочнокисле), естерифікація. Демонстрації: 27. Взаємодія глюкози з аргентум(Ι) оксидом. Лабораторні досліди: 16. Взаємодія глюкози з купрум(ІІ) гідроксидом. Інструкція з Т.Б. №1,3,6,8-12. | |
| 86. | Застосування глюкози, її біологічне значення. Короткі відомості про фруктозу, рибозу та дезоксирибозу. Поняття про оптичну ізомерію. | |
| 87. | Сахароза, її склад, будова. Фізичні властивості. Поширеність у природі. Хімічні властивості: гідроліз, утворення сахаратів. Демонстрації: 28. Гідроліз сахарози. 29. Взаємодія сахарози з гідроксидами металічних елементів. Інструкція з Т.Б. №1,3,6,8-12. | |
| 88. | Добування цукру з цукрових буряків (загальна схема). Розв’язування розрахункових задач. | |
| 89. | Крохмаль, його склад. Будова крохмалю. Фізичні властивості. Хімічні властивості: гідроліз (кислотний, ферментативний), реакція з йодом. Біологічне значення крохмалю. Демонстрації: 30. Гідроліз крохмалю (целюлози). Лабораторні досліди: 17. Відношення крохмалю до води. 18. Взаємодія крохмалю з йодом. Інструкція з Т.Б. №1,3,6,8-12. | |
| 90. | Целюлоза, її склад. Будова целюлози. Фізичні властивості. Хімічні властивості: окиснення, гідроліз, естерифікація, термічний розклад. | |
| 91. | Застосування целюлози та її похідних. Поняття про штучні волокна на прикладі ацетатного волокна. | |
| 92. | Практичні роботи: 8. Розв’язування експериментальних задач. Інструкція з Т.Б. №1,3,6,8-12. | |
| 93. | Узагальнення та систематизація вивченого матеріалу. Генетичний зв’язок між класами органічних речовин. | |
| 94. | ПІДСУМКОВИЙ УРОК. Тематичне оцінювання. КОНТРОЛЬНА РОБОТА №1. | |
| 95. | ТЕМА 6. НІТРОГЕНОВМІСНІ СПОЛУКИ (20 год.). Нітросполуки, їх склад. Найважливіші представники нітросполук, їх застосування. | |
| 96. | Аміни, їх склад, хімічна, електронна будова, класифікація, номенклатура. | |
| 97. | Аміни як органічні основи. Взаємодія амінів з водою і кислотами. Демонстрації: 31. Досліди з метанаміном (або з іншим летким аміном): горіння, лужні властивості розчину, утворення солей. Інструкція з Т.Б. №1,3,6,8-12. | |
| 98. | Ароматичні аміни. Анілін, його склад, електронна будова молекули, фізичні властивості. | |
| 99. | Хімічні властивості аніліну: взаємодія з мінеральними кислотами, бромною водою, реакція сульфування. Демонстрації: 32.Взаємодія аніліну з хлоридною кислотою. 33. Взаємодія аніліну з бромною водою. Інструкція з Т.Б. №1,3,6,8-12. | |
| 100. | Взаємний вплив атомів у молекулі аніліну. | |
| 101. | Добування амінів з нітросполук. Реакція М.Зініна. Значення аніліну в органічному синтезі. | |
| 102. | Поняття про синтетичні лікарські препарати (на прикладі ацетилсаліцилової кислоти). | |
| 103. | Амінокислоти. Склад, будова молекул. Ізомерія амінокислот, номенклатура. | |
| 104. | Особливості хімічних властивостей амінокислот, зумовлені поєднанням аміно- і карбоксильної груп. Біполярний йон. Демонстрації: 34. Доведення наявності функціональних груп у розчинах амінокислот. Інструкція з Т.Б. №1,3,6,8-12. | |
| 105. | Пептиди. Пептидний зв’язок. | |
| 106. | Добування a -амінокислот, їх біологічне значення. | |
| 107. | Білки. Білки як високомолекулярні сполуки. Основні амінокислоти, що беруть участь в утворенні білків. | |
| 108. | Рівні структурної організації білків. | |
| 109. | Властивості білків: гідроліз, денатурація, кольорові реакції. Демонстрації: 35. Розчинення й денатурація білка. Лабораторні досліди: 19. Кольорові реакції білків. Інструкція з Т.Б. №1,3,6,8-12. | |
| 110. | Успіхи у вивченні і синтезі білків. Поняття про біотехнологію. | |
| 111. | Нуклеїнові кислоти. Склад нуклеїнових кислот. | |
| 112. | Будова подвійної спіралі ДНК. | |
| 113. | Роль нуклеїнових кислот у життєдіяльності організмів. | |
| 114. | ПІДСУМКОВИЙ УРОК. Тематичне оцінювання й коригування знань учнів. | |
| 115. | ТЕМА 7. СИНТЕТИЧНІ ВИСОКОМОЛЕКУЛЯРНІ РЕЧОВИНИ І ПОЛІМЕРНІ МАТЕРІАЛИ НА ЇХ ОСНОВІ (17 ГОД.).Методи синтезу високомолекулярних речовин: полімеризація і поліконденсація. | |
| 116. | Лінійна, просторова та розгалужена будова полімерів. | |
| 117. | Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери. Лабораторні досліди: 20. Дослідження властивостей термопластичних полімерів. Інструкція з Т.Б. №1,3,6,8-12. | |
| 118. | Поліетилен, поліпропілен, полівінілхлорид. | |
| 119. | Полівінілхлорид, полістирол, поліметилметакрилат. | |
| 120. | Фенолоформальдегідні смоли. Розв’язування розрахункових задач. | |
| 121. | Склад, властивості, застосування пластмас на їхній основі. | |
| 122. | Практичні роботи: 9. Розпізнавання деяких пластмас і волокон. Інструкція з Т.Б. №1,3,6,8-12. | |
| 123. | Синтетичні каучуки, їхні властивості та застосування. Гума. Демонстрації: 36. Зразки пластмас, синтетичних волокон, каучуків. Лабораторні досліди: 21. Порівняння властивостей каучуку і гуми. Інструкція з Т.Б. №1,3,6,8-12. | |
| 124. | Синтетичні волокна. Поліестерні та поліамідні волокна, їх склад, властивості, застосування. Лабораторні досліди: 22. Відношення синтетичних волокон до розчинів кислот і лугів. Інструкція з Т.Б. №1,3,6,8-12. | |
| 125. | Розв’язування розрахункових задач. | |
| 126. | Багатоманітність органічних речовин, причини багатоманітності. Природні і синтетичні органічні речовини. | |
| 127. | Практичні роботи: 10. Функціональний аналіз органічних речовин. Інструкція з Т.Б. №1,3,6,8-12. | |
| 128. | Рівні структурної організації органічних речовин (молекулярний, полімерний, супрамолекулярний) та їхня ієрархія. | |
| 129. | Генетичні зв’язки між органічними речовинами. | |
| 130. | Практичні роботи: 11. Розв’язування експериментальних задач із вивченого курсу (генетичні зв’язки між органічними речовинами, дослідження їх властивостей). Інструкція з Т.Б. №1,3,6,8-12. | |
| 131. | ПІДСУМКОВИЙ УРОК. Тематичне оцінювання й коригування знань учнів. | |
| 132. | УЗАГАЛЬНЮВАЛЬНЕ ПОВТОРЕННЯ НАЙВАЖЛИВІШИХ ПИТАНЬ КУРСУ ХІМІЇ. ТЕМА 1. ОСНОВНІ ЗАКОНИ Й ТЕОРІЇ (11 ГОД.).Закон збереження маси речовин. Сталість складу речовин. Закон об’ємних відношень. | |
| 133. | Закон Авогадро та наслідки з нього. Розрахунки за цими законами. | |
| 134. | Розрахункові задачі: 1. Обчислення об’єму газуватої речовини у хімічних реакціях за законами Авогадро та об’ємних відношень газів. | |
| 135. | Теорія хімічної будови. Ізомерія, взаємний вплив атомів. Наукове значення теорії. | |
| 136. | Сучасні уявлення про будову атома. | |
| 137. | Періодичний закон і періодична система хімічних елементів Д.Менделєєва у світлі теорії будови атомів. Демонстрації: 1. Таблиці – періодична система хімічних елементів, шкала електронегативностей. Інструкція з Т.Б. №1,6. | |
| 138. | Електронні конфігурації атомів. Принцип найменшої енергії, принцип Паулі, правило Гунда. | |
| 139. | Періодична зміна властивостей атомів хімічних елементів та їхніх сполук. | |
| 140. | Радіус атомів. Енергія іонізації. Спорідненість до електрона. Електронегативність. | |
| 141. | Роль періодичного закону в сучасному природознавстві. | |
| 142. | Тестування. ПІДСУМКОВИЙ УРОК. Тематичне оцінювання й коригування знань учнів. | |
| 143. | ТЕМА 2. РОЗВИТОК НАУКОВИХ ЗНАНЬ ПРО ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВУ РЕЧОВИНИ (12 год.). Сучасні уявлення про природу хімічного зв’язку. Ковалентний зв’язок, способи його утворення. | |
| 144. | Гібридизація електронних орбіталей атомів. | |
| 145. | Просторова будова молекул. | |
| 146. | Йонний зв'язок. Йонні кристали. | |
| 147. | Металічний зв'язок. | |
| 148. | Водневий зв'язок. | |
| 149. | Міжмолекулярна взаємодія. | |
| 150. | Валентність елементів у світлі електронної теорії хімічного зв’язку. | |
| 151. | Валентність і ступінь окиснення. | |
| 152. | Окисно-відновіні реакції. | |
| 153. | Практичні роботи: 1.Виконання окисно-відновних реакцій і вправ на складання їхніх рівнянь. Інструкція з Т.Б. №1,3,6,8-12. | |
| 154. | ПІДСУМКОВИЙ УРОК. Тематичне оцінювання й коригування знань учнів. | |
| 155. | ТЕМА 3. ДИСПЕРСНІ СИСТЕМИ (12 год.). Загальні уявлення про дисперсні системи. Класифікація дисперсних систем їх характерні ознаки. | |
| 156. | Колоїдні розчини. Значення колоїдних розчинів у природі та на виробництві. Істинні розчини. Криві розчинності. Коефіцієнт розчинності. | |
| 157. | Способи кількісного вираження складу розчину: масова частка і молярна концентрація розчиненої речовини. Розрахункові задачі: 2. Обчислення коефіцієнту розчинності речовин. | |
| 158. | Розрахункові задачі: 3. Обчислення масової частки. 4. Обчислення молярної концентрації розчиненої речовини. | |
| 159. | Теорія електролітичної дисоціації. Ступінь і константа дисоціації. Чинники, від яких залежать ступінь і константа дисоціації. | |
| 160. | Дисоціація води, йонний добуток води. Водневий показник (рН). Демонстрації: 2. Визначення кислотності середовища. Інструкція з Т.Б. №1,6,8,10-12. | |
| 161. | Реакції у розчинах електролітів. Лабораторні досліди: 1.Реакція обміну між розчинами електролітів. Інструкція з Т.Б. №1,6,8,10-12. | |
| 162. | Практичні роботи: 2. Реакція обміну між розчинами електролітів. Інструкція з Т.Б. №1,6,8,10-12. | |
| 163. | Практичні роботи: 3.Складання йонних рівнянь. Інструкція з Т.Б. №1,6,8,10-12. | |
| 164. | Гідроліз солей. Значення гідролізу в природних процесах, життєдіяльності людини та живленні рослин. | |
| 165. | Практичні роботи: 4. Гідроліз солей і визначення рН середовища. Інструкція з Т.Б. №1,6,8,10-12. | |
| 166. | ПІДСУМКОВИЙ УРОК. Тематичне оцінювання й коригування знань учнів. | |
| 167. | ТЕМА 4. ХІМІЧНІ РЕАКЦІЇ (12 год.).Суть хімічних реакцій, їх класифікація в неорганічний та органічній хімії. | |
| 168. | Енергетика хімічних перетворень. Тепловий ефект реакції. Демонстрації: 3. Приклади екзо- та ендотермічних реакцій. | |
| 169. | Розрахункові задачі: 5. Обчислення за термохімічними рівняннями реакцій. | |
| 170. | Швидкість хімічних реакцій її залежність від умов перебігу реакцій. Демонстрації: 4. Досліди, що підтверджують залежність швидкості реакції від концентрації реагуючих речовин і температури. | |
| 171. | Розрахункові задачі: 6. Обчислення середньої швидкості реакції. | |
| 172. | Каталіз у неорганічний та органічній хімії. Демонстрації: 5. Розкладання гідроген пероксиду за участю каталізатора манган(ІV) оксиду або взаємодія алюмінію (алюмінієвий пил) з йодом (дрібнокристалічним) за участю води як каталізатора. | |
| 173. | Механізм каталітичної дії. ″Отруєння″ каталізаторів. Значення каталізу. | |
| 174. | Практичні роботи: 5. Окисно-відновні реакції. Інструкція з Т.Б. №1,6,8,10-12. | |
| 175. | Оборотні та необоротні реакції. Принцип Ле Шательє. Демонстрації: 6. Зміщення рівноваги у розчині амоніаку при нагріванні або в системі нітроген(ІІ) оксид – нітроген(ІV) оксид. 7. Приклади окисно-відновних реакцій розкладу солей (калій перманганату, амоній дихромату). | |
| 176. | Практичні роботи: 6. Якісні реакції на неорганічні речовини. Інструкція з Т.Б. №1,6,8,10-12. | |
| 177. | Практичні роботи: 7. Якісні реакції на органічні речовини. Інструкція з Т.Б. №1,6,8-12. | |
| 178. | ПІДСУМКОВИЙ УРОК. Тематичне оцінювання й коригування знань. КОНТРОЛЬНА РОБОТА №2. | |
| 179. | ТЕМА 5. РОЛЬ ХІМІЇ У ЖИТТІ СУСПІЛЬСТВА (5 год.). Місце хімії серед наук про природу. Значення хімії для розуміння природничо-наукової картини світу. | |
| 180. | Роль хімії у розв’язанні продовольчої проблеми. | |
| 181. | Роль хімії у розв’язанні сировинної проблеми. | |
| 182. | Роль хімії у розв’язанні енергетичної проблеми. | |
| 183. | Роль хімії у розв’язанні екологічної проблеми, збереженні здоров’я. | |
| 184. | Резерв часу | 1 |
| 185. | Резерв часу | 1 |
| 186. | Резерв часу | 1 |
| 187. | Резерв часу | 1 |
| 188. | Резерв часу | 1 |
| 189. | Резерв часу | 1 |
| 190. | Резерв часу | 1 |
| 191. | Резерв часу | 1 |
| 192. | Резерв часу | 1 |
| 193. | Резерв часу | 1 |
| 194. | Резерв часу | 1 |
| 195. | Резерв часу | 1 |
| 196. | Резерв часу | 1 |
| 197. | Резерв часу | 1 |
| 198. | Резерв часу | 1 |
| 199. | Резерв часу | 1 |
| 200. | Резерв часу | 1 |
| 201. | Резерв часу | 1 |
| 202. | Резерв часу | 1 |
| 203. | Резерв часу | 1 |
| 204. | Резерв часу | 1 |
| 205. | Резерв часу | 1 |
| 206. | Резерв часу | 1 |
| 207. | Резерв часу | 1 |
| 208. | Резерв часу | 1 |
| 209. | Резерв часу | 1 |
| 210. | Резерв часу | 1 |
для загальноосвітніх навчальних закладів 11-річної школи
природничий (хіміко – біологічний) профіль навчання
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!