
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Робота № 2/2. Визначення парціальних мольних об'ємів
|
|
|
|
Мета роботи. Точно виміряти густини подвійних рідких розчинів та обрахувати парціальні мольні об'єми їх компонентів.
Методика роботи. Розчин можна характеризувати за допомогою термодинамічних величин (V, H, U, F, G), що відносяться до розчину в цілому. Часто буває важливо знати, як додавання саме даного компонентна впливає на ту чи іншу властивість розчину. Вирішення цієї задачі досягається уведенням парціальних мольних величини.
Нехай бінарний розчин містить n1 молів речовини А та n2 молів речовини В. Екстенсивну властивість розчину позначимо g. Тоді парціальна мольна величина першого компонента визначається із співвідношення:
 (1)
(1)
Те ж саме для другого компонента:
 (2)
(2)
Можна показати (1), що для будь-якої екстенсивної характеристики бінарного розчину має місце така залежність:
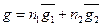 (3)
(3)
Парціальні мольні об'єми V1 та V2 можна визначити, вимірюючи густину розчинів різної концентрації. Для проведення розрахунків корисним є уведення величини уявного об'єму ФV.
Уявний мольний об'єм визначається із співвідношення:
 (4)
(4)
де V - об'єм розчину, що містить n1 молів першого компонента та n2 молів другого компонента; V10 - молярний об'єм першого компонента за даних T та Р.
Коли 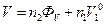 , маємо
, маємо
 (5)
(5)
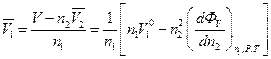 (6)
(6)
За допомогою експериментально виміряної густини розчину ρ та молекулярних маc компонентів M1 та M2 величину ФV може бути визначено таким чином:
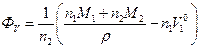 (7)
(7)
Якщо концентрацію розчину виражено через моляльність (кількість молів розчиненої речовини у 1000 г розчинника), то
 (8)
(8)
де ρ1 - густина чистого розчинника; ρ - густина розчину; m-моляльність розчину, M2 - молекулярна маса розчиненої речовини.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 300; Нарушение авторских прав?; Мы поможем в написании вашей работы!