
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адиабатный процесс
|
|
|
|
8------------------
Обратимые и необратимые процессы
Газ находится в сосуде, закрытом поршнем. Выдвигаем поршень. Это необратимый процесс, потому что его нельзя вернуть в обратное состояние через те же промежуточные состояния системы!
Чтобы расширить газ обратимым образом, нужно выдвигать поршень бесконечно медленно. При этом давление газа будет во всем объеме одинаковым.
Необратимыми являются процессы, при которых механическая энергия переходит во внутреннюю при наличие трения. В отсутствие трения все механические процессы протекали бы обратимо.
Таким образом, равновесные обратимые процессы являются абстракцией из-за существующих трения и теплообмена.
Смесь газов. Закон Дальтона.
Остановимся еще вкратце на смеси идеальных газов.
Смесью газов называется совокупность нескольких разнородных газов, которые при рассматриваемых условиях не вступают друг с другом в химические реакции.
Смесь газов – гомогенная термодинамическая система (внутри которой нет поверхностей раздела, отделяющих друг от друга макроскопические части системы, различающиеся по своим свойствам и составу).
Парциальным давлением Pii-го газа в смеси называется давление, под которым находился бы этот газ, если бы из смеси были удалены все остальные газы, а V и T остались прежними.
Закон Дальтона: в случае идеальных газов сумма парциальных давлений равна давлению всей газовой смеси: P = P1 + P2 +…+ Pn
(8)
аналогично и для парциальных объемов:
– закон Амага (9)
При расчете параметров состояния смеси идеальных газов можно пользоваться уравнением Менделеева-Клапейрона в форме:
, (10)
где М – масса всей системы;
– кажущийся молекулярный вес.
Для реальных газов наблюдаются отступления, которые будут разобраны на более поздних лекциях.
9. Изохорный процесс (v=const)
Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) при v=const. В pv -координатах график процесса представляет собой прямую линию, параллельную оси p. Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’).
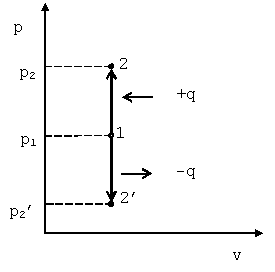
|
| Рис. 4.1. График изохорного процесса в p-v координатах |
Запишем для точек 1 и 2 уравнения состояния: p1·v=R·T1; p2·v=R·T2. Следовательно, для изохорного процесса

| (4.6) |
Приращение внутренней энергии газа
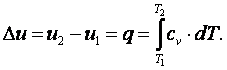
| (4.7) |
Работа газа

|
так как dv=0.
Энтальпия газа iv=u+p·v, а div=du+d(p·v)=du+p·dv+v·dp=du+v·dp. Поэтому
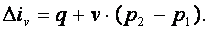
| (4.8) |
Энтропия 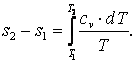
То есть
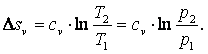
| (4.9) |
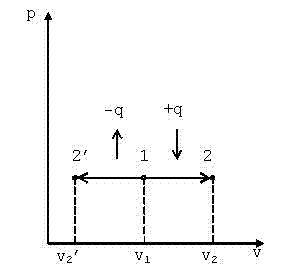
10. Изобарный процесс (p=const)
В p-v координатах график процесса представляет собой прямую линию параллельную оси v (рис. 4.2). Изобарный процесс может протекать с увеличением объёма (процесс 1-2) и с уменьшением (процесс 1-2’). Запишем для точек 1 и 2 уравнения состояния: p·v1=R·T1; p·v2=R·T2.
|
| Рис. 4.2. График изобарного процессав p-v координатах |
Следовательно, для изобарного процесса

| (4.10) |
Приращение внутренней энергии газа 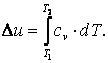 Работа газа
Работа газа 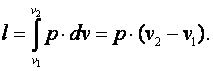 Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.
Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.
Используя выражение (4.5), можно показать, что в изобарном процессе энтропия газа

|
11. Изотермический процесс (T=const)
В p-v координатах график процесса изображается равнобокой гиперболой (рис. 4.3). Изотермический процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).

|
| Рис. 4.3. График изотермического процесса в p-v координатах |
Запишем для точек 1 и 2 уравнения состояния p1·v1=R·T; p2·v2=R·T. Следовательно, для изотермического процесса p1·v1=p2·v2=const.
Приращение внутренней энергии газа
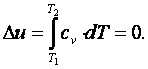
|
Работа газа

| (4.12) |
Теплота, подводимая в процессе
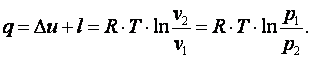
| (4.13) |
Изменение энтальпии газа Δi=Δu+Δ(p·v)=0.
Изменение энтропии газа

|
Адиабатный процесс – это процесс, при котором рабочее тело не обменивается теплотой с окружающей средой (dq=0). Для получения графика процесса в p-v координатах выполним некоторые преобразования.
В соответствии с первым законом термодинамики dq=cv·dT+p·dv=c·dT, где с – теплоёмкость термодинамического процесса. Тогда можно записать, что

| (4.15) |
Продифференцируем уравнение состояния идеального газа и запишем

| (4.16) |
Так как R=cp-cv, то выражение (4.15) можно переписать с учётом (4.16) следующим образом:
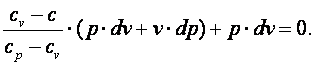
| (4.17) |
Выполним преобразования выражения (4.17).
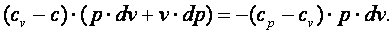
|
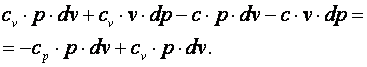
|
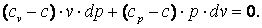
| (4.18) |
Разделим выражение (4.18) на (cv-c)·p·v и получим:
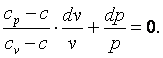
| (4.19) |
Обозначим 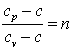 , тогда
, тогда

|

|

|

|
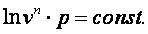
|
Следовательно
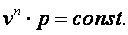
| (4.20) |
В адиабатном процессе dq=0, то есть c·dT=0. Поэтому c=0. Значит в адиабатном процессе  . Эту величину принято обозначать буквой
. Эту величину принято обозначать буквой 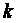 и называть показателем адиабаты.
и называть показателем адиабаты.
Поэтому в p-v координатах адиабатный процесс изображается неравнобокой гиперболой vk·p=const (рис. 4.4). Так как k>1, то адиабата проходит круче гиперболы. Адиабатный процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).

| |
| Рис. 4.4. График адиабатного процесса в p-v координатах |
Запишем для точек 1 и 2 уравнения состояния p1·v1=R·T1; p2·v2=R·T2. Так как в адиабатном процессе p1·v1k=p2·v2k, то  ,
,  ,
, 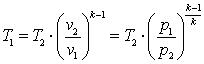 .
.
Приращение внутренней энергии газа  .
.
Так как 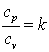 , а
, а 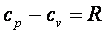 , то
, то 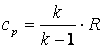 , а
, а 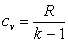 . Поэтому
. Поэтому
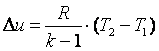
| (4.21) |
Работа газа в адиабатном процессе выполняется за счёт его внутренней энергии. Так как в адиабатном процессе отсутствует обмен теплотой с окружающей средой, то в соответствии с первым законом термодинамики имеем l+Δu=0 или l=-Δu. Поэтому
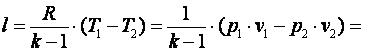
|

| (4.22) |
Изменение энтальпии газа в адиабатном процессе может быть определено исходя из следующих соображений:
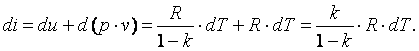
|
Так как  , то в итоге получим
, то в итоге получим

| (4.23) |
Энтропия газа в адиабатном процессе не изменяется, так как dq=0. Поэтому в T-s координатах адиабатный процесс изображается прямой линией, параллельной оси температур.
13.Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В соответствии с сущностью понятия теплоёмкости, предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными (удельные теплоёмкости идеального газа при постоянном объёме и постоянном давлении соответственно равны iR/(2M) и (i+2)R/(2M) и не меняются при изменении термодинамических параметров).

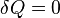
14. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
pV = nRT
где R – универсальная газовая постоянная.
Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации.
Так, для газов с низкой температурой сжижения (He, H2, Ne и даже N2, O2, Ar, CO, CH4) при давлениях до 50 атм отклонения не превышают 5%, а при давлениях до 10 атм – 2%. Легко конденсирующиеся газы (CO2, SO2, Cl2, CH3Cl) уже при 1 атм обнаруживают отклонения до 2 – 3%.
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
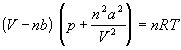 или для одного моля
или для одного моля 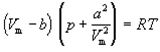
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2350; Нарушение авторских прав?; Мы поможем в написании вашей работы!