
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроды первого рода
|
|
|
|
Электроды первого рода
В основе методов
Кондуктометрия Потенциометрия
измерение измерение электродвижущей
электрической силы электродов в растворе
проводимости электролитов
исследуемых растворов
электролитов
Электродом, или полу элементом, называется система, состоящая из двух контактирующих разнородных проводников - электронного (металл) и ионного (раствор электролита), на межфазной границе между которыми возникает двойной электрический слой, характеризующийся определенным значением потенциала (φ).
Различают следующие типы электродов:
• первого рода – обратимые относительно катиона или аниона, и первого рода – газовые;
• второго рода – обратимые одновременно относительно катиона и аниона;
• окислительно-восстановительные электроды– с окисленной и восстановленной формами в одной (жидкой) фазе;
• ионообменные (ионоселективные).
- это электроды, состоящие из металла или неметалла, погруженного в раствор с одноименными ионами.
- это электроды, состоящие из металла или неметалла, погруженного в раствор с одноименными ионами.
Примером может служить медная пластинка или проволока, находящаяся в растворе соли меди.
Такой электрод обозначается CulCu2+, где черта обозначает границу раздела между фазами – металлом и раствором, содержащим его ионы.
Примером электрода из неметалла, находящегося в растворе с одноименными ионами, может служить йодный электрод J2│2J–.
Если φ на границе раздела фаз определяется обратимым переходом катионов металла из раствора на металл и наоборот, то считают, что этот электрод обратим относительно катиона.
Если φ определяется обратимым переходом анионов из раствора на поверхность электрода и наоборот, то такой электрод обратим относительно аниона.
Расчет потенциалов электродов производится по уравнению Нернста.
К электродам первого рода также относятся газовые электроды.
Любой газовый электрод состоит из металлического проводника, контактирующего одновременно с определенным газом и с раствором, содержащим ионы этого газа.
Металлический проводник выполняет роль не только проводника электронов, но и катализатора.
Этому требованию лучше всего удовлетворяет платина с высокоразвитой поверхностью – платинированная платина или платиновая чернь.
Уравнение Нернста:
Для электродов I рода, обратимых относительно катиона: 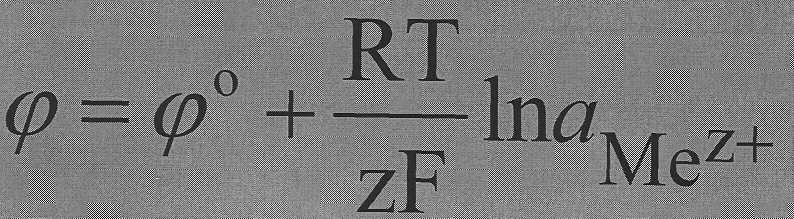
Для электродов I рода, обратимых относительно аниона: 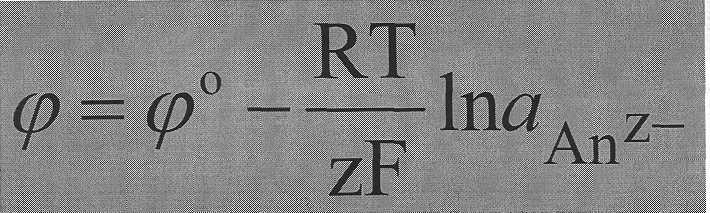
где а( Меz+) – активность соответствующих ионов металла в растворе,
z – количество электронов, принимающих участие в электродном процессе,
F – число Фарадея.
Величину φо называют стандартным электродным потенциалом
(в таблице)
Электроды второго рода- это металлический проводник, покрытый слоем труднорастворимого соединения металла (соли, оксида или гидроксида) и погруженный в раствор электролита, содержащего тот же анион, что и труднорастворимоесоединение металла.
Примерами электродов второго рода служат хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в раствор КС1 определенной концентрации (обычно насыщенный раствор КС1) и солевого мостика, соединяющего этот раствор с исследуемым раствором.
Электрохимическая цепь хлорсеребряного электрода записывается так:
Ag, AgCl l КС1(нас).

В хлорсеребряном электроде на межфазной границе протекает следующая реакция:
AgCl(т) + ↔ Ag(т) + Сl-
Хлорсеребряный электрод обратим не только относительно катиона, но и относительно аниона, поэтому выражение для электродного потенциала хлорсеребряного электрода имеет вид: 
Окислительно-восстановительные электроды (редокс-электроды)- это такие электроды, металл которых не принимает участия в окислительно-восстановительной реакции, а является только переносчиком электронов;
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2954; Нарушение авторских прав?; Мы поможем в написании вашей работы!