
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение параметров для основных точек цикла
|
|
|
|
Расчет газового цикла при постоянной теплоемкости
Теплоемкость в этом варианте расчета не зависит от температуры, с ¹ f (t), и определяется по молекулярно-кинетической теории. Так как рабочим телом согласно заданию является воздух, то теплоемкости определяются для двухатомного газа.
Изохорная теплоемкость:


Изобарная теплоемкость:


Удельная газовая постоянная определяется из соотношения


Параметры p, V, T определяются c использованием уравнения состояния (4) и соотношений параметров в процессах

T1 = 273,15+800C = 353 К,
где T1 – температура точки цикла,
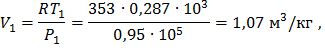
где 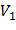 – объем точки цикла,
– объем точки цикла,

Рассмотрим процесс 1 – 2: Адиабата

Преобразуем формулу (5)
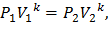

где k – показатель адиабаты.
Выразим 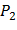 из формулы (6), где k = 1,4,
из формулы (6), где k = 1,4,

 .
.
В формулу (7) подставляем соотношение параметров для адиабаты, получаем формулу (8) и выражаем V2:



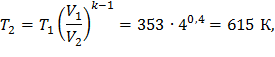

Из графика видно:
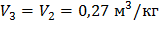 ,
,
 .
.
Рассмотрим процесс 2 – 3: Изохора



 .
.
Рассмотри процесс 3 – 4: Политропа





В формулу (7) подставляем соотношение параметров для политропы, получаем формулу (12) и выражаем T4:
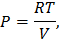

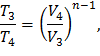
где n – показатель политропы,

Параметры U, i, S определяют, выбрав начало отсчета. Условно считая при t0 =0 0 C, Р0 = 760 мм рт. ст. = 101325 Па удельную внутреннюю энергию, удельную энтальпию и удельную энтропию идеального газа равными нулю, получаем:
U = CV T, (13)
i = CP T, (14)

где P – давление[бар],
i – удельная энтальпия,
U – удельная внутренняя энергия,
S – удельная энтропия.
Находим параметр U по формуле (13),
где CV = 717,46 Дж/(кг  К):
К):
 = CV T1 = 717,46
= CV T1 = 717,46  353 = 253265,498 Дж/кг =253,3 кДж/кг;
353 = 253265,498 Дж/кг =253,3 кДж/кг;
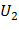 = CV T2 = 717,46
= CV T2 = 717,46  615 = 441,2 кДж/кг;
615 = 441,2 кДж/кг;
 = CV T3 = 717,46
= CV T3 = 717,46  1476 = 1059 кДж/кг;
1476 = 1059 кДж/кг;
 = CV T4 = 717,46
= CV T4 = 717,46  1120 = 803,5кДж/кг.
1120 = 803,5кДж/кг.
Находим параметр i по формуле (14),
где Ср =1004,45 Дж/(кг  К):
К):
i1 = CP T1 = 1004,45  353 = 354570,85 Дж/кг = 354,57 кДж/кг;
353 = 354570,85 Дж/кг = 354,57 кДж/кг;
i2 = CP T2 = 1004,45  615 = 617,74 кДж/кг;
615 = 617,74 кДж/кг;
i3 = CP T3 = 1004,45  1476 = 1482,6кДж/кг;
1476 = 1482,6кДж/кг;
i4 = CP T4 = 1004,45  1120 = 1124,9кДж/кг.
1120 = 1124,9кДж/кг.
Находим параметр S по формуле (15):








Результаты определения параметров в точках сводятся в таблицу 1.
Таблица 1 – Результаты определения параметров в точках
| № точки | P, 105 Па | V, м3/кг | t, 0C | Т, К | U, кДж/кг | i, кДж/кг | S, кДж/(кг·К) |
| 0,95 | 1,07 | 253,3 | 354,57 | 0,276 | |||
| 6,62 | 0,27 | 441,2 | 617,74 | 0,277 | |||
| 15,9 | 0,27 | 1482,6 | 0,904 | ||||
| 3,04 | 1,07 | 803,5 | 1124,9 | 1,102 |
2.2 Определение 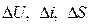 для каждого процесса
для каждого процесса
Изменение удельной внутренней энергии:
 , (16)
, (16)
где DU1 – изменение удельной внутренней энергии.
Находим параметр  по формуле (16):
по формуле (16):
DU1-2 = СV (T2-T1) = 717,46(615–353) = 187,97кДж/кг;
DU2-3 = СV (T3-T2) = 717,46(1476–615) = 617,73кДж/кг;
DU3-4 = СV (T4-T3) = 717,46(1120–1476) = –255,41кДж/кг;
DU4-1 = СV (T1-T4) = 717,46(353–1120) = –550,29кДж/кг.
Изменение удельной энтальпии:
 , (17)
, (17)
где Di – изменение удельной энтальпии.
Находим параметр Di по формуле (17):
Di1-2 = Сp(T2-T1)= 1004,45(615–353) =263,16кДж/кг;
Di2-3 = Сp(T3-T2)= 1004,45(1476–615) =864,83кДж/кг;
Di3-4 = Сp(T4-T3)= 1004,45(1120–1476)= –357,58кДж/кг;
D i4-1 = Сp(T1-T4)= 1004,45(353–1120)= –770,41кДж/кг.
Изменение удельной энтропии:
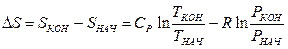 , (18)
, (18)
где 
Находим параметр DS по формуле (18):




Результаты параметров для каждого процесса сводятся в таблицу 2.
Таблица 2 – Данные расчетов
| № процессов |  , кДж/кг , кДж/кг
|  , кДж/кг , кДж/кг
|  , кДж/(кг·К) , кДж/(кг·К)
| Примечания |
| 1-2 | 187,97 | 263,16 | 
| |
| 2-3 | 617,73 | 864,83 | 
| |
| 3-4 | –255,41 | –357,58 | 
| |
| 4-1 | –550,29 | –770,41 | 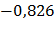
| |
| Всего: | 
| 
| 
| - |
2.3 Определение q, l, lI, j, y в каждом процессе
Удельное количество теплоты определяется для всех процессов из уравнения первого закона термодинамики:
 . (19)
. (19)
Для адиабатного:
q 1-2 =0 (n=k),
где q – удельное количество теплоты.
Для изохорного:
q 2-3 =DU= U3-U2 =1059–441,2=617,8 (l=0);
q 4-1 =DU= U1-U4 =253,3–803,5= –550,2 (l=0).
Для политропного:
q 3-4 = СV  (T4-T3); (20)
(T4-T3); (20)

Удельная работа изменения объема газа в процессах определяется по формуле (21):

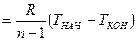 . (21)
. (21)
Для адиабатного:


Для изохорного:
l 2-3=0,
где l – удельная работа;
l 4-1=0 (n =¥).
Для политропного:

Удельная располагаемая работа (полезная) в процессах определяется по формуле (22):
l¢ = – 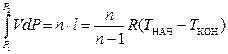 , (22)
, (22)
где l¢ - удельная располагаемая(полезная) работа.
Для адиабатного:

Для изохорного:


Для политропного:

Коэффициенты распределения энергии в процессе:


Результаты параметров сводятся в таблицу 3.
Таблица 3 – Результаты определения параметров в каждом процессе
| № процессов | q, кДж/кг | l, кДж/кг | l¢, кДж/кг | 
| 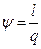
| |
| 1-2 | –187,9 | –263,1 | ||||
| 2-3 | 617,8 | –250,56 | 0,99 | |||
| 3-4 | 255,4 | 510,7 | 612,82 | –1 | 1,9 | |
| 4-1 | –550,2 | 223,63 | ||||
| Всего: | 
| 
| 
| – | – |
2.4 Определение l Ц, ht, Pi
Полезная работа газа за цикл определяется:
- как разность работ расширения и сжатия,
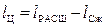 , (25)
, (25)
где l Ц – полезная работа газа за цикл,
- как разность теплоты, подведенной и отведенной:
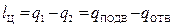 . (26)
. (26)
С учетом знаков плюс и минус полезная работа за цикл определяется как алгебраическая сумма:
 , (27)
, (27)
или
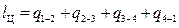 , (28)
, (28)
или
 , (29)
, (29)
Определяем по формуле (27):

Знак плюс соответствует положительному направлению процесса, то есть подводу тепла и расширению. Знак минус – отводу тепла и сжатию.
Термический к.п.д.:

где ht – термический к. п. д.,
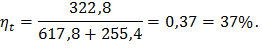
Термический к.п.д. цикла, по формуле (31):

Среднецикловое давление (индикаторное):

где Pi – среднецикловое давление,
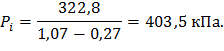
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2343; Нарушение авторских прав?; Мы поможем в написании вашей работы!