
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тпл Тисп Т, К
|
|
|
|
Жидк
 |
 тв
тв 
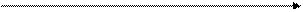
Рис. 2. Изменение энтропии в зависимости от температуры при наличии фазовых переходов твердое тело – жидкость - газ
Для некоторых веществ промежуточное жидкое состояние отсутствует, и твердое вещество сразу же переходит в газовую фазу.
Этот процесс называется сублимацией. Такие переходы наблюдаются для J2(тв) → 2J(газ); S(тв) → S(газ). Для этого случая изменение энтропии с температурой меняется согласно рис. 3.
 S, Дж/моль.К
S, Дж/моль.К
 газ
газ
 |

 тв
тв
 0 Т исп Т, К
0 Т исп Т, К
Рис. 3. Изменение энтропии в зависимости от температуры при наличии процесса сублимации вещества
Для фазовых переходов, происходящих в изобарно-изотермических условиях, наблюдается равновесие между двумя агрегатными состояниями вещества, например, пар-жидкость или твердое тело-жидкость. При равновесии энергия Гиббса (см.ниже) ∆ G = ∆ Н - Т ∆ S = 0 и, следовательно, изменение энтропии равно
∆ S фп = ∆ Н ф.п./ T фп (р = const). (12)
Энтропия проявляет аддитивные свойства, т.е. пропорциональна массе вещества, а в системе, состоящей из двух частей, энтропия равна сумме энтропий ее составных частей:
S = S 1 + S 2 = R ln W 1 + R ln W 2 = R ln(W 1 W 2). (13)
Изменение энтропии для реакции аА + вВ = сС + дД может быть рассчитано по уравнению (например, для стандартных условий):
∆ S 0 298хр = [с S 0 298(С) + д S 0 298(Д)] – [а S 0 298(А) + в S 0 298(В)] (14)
или D S 0 298хр = S (n i S 0 298)прод - S (n i S 0298)исх. (15)
ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ (Постулат Планка)
В 1911 г. М. Планк высказал постулат: Энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю.
Следует подчеркнуть, что вещество в этом случае должно быть абсолютно чистым, а сам кристалл не должен иметь дефектов, так как все эти факторы увеличивают число микросостояний вещества, а значит и энтропию.
Изменение энтропии при переходе от Т = 0 К к температуре 25 0С равно
∆ S = S °298 – S 0. (16)
но S 0 = 0 и поэтому энтропия веществ при стандартных условиях в таблицах показана не как ∆ S, а как S о298 .
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!