
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смеси идеальных газов
Смеси идеальных газов являются также идеальными газами и подчиняются уравнению состояния идеальных газов (уравнению Клапейрона)
 , (209)
, (209)
где 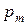 ,
, 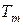 – давление и температура смеси.
– давление и температура смеси.
Средняя температура и среднее давление смеси характеризуют конечное состояние диффузионного равновесия смеси.
Состояние компонентов смеси в процессе перемешивания непрерывно изменяется, начиная с момента первичного выравнивания давлений компонентов и кончая состоянием диффузионного равновесия, когда давление каждого из компонентов снижается до уровня стабильного парциального давления  .
.
Закон диффузионного равновесия смеси идеальных газов (закон Дальтона) характеризует установившееся состояние газовой смеси и формулируется следующим образом: каждый компонент смеси ведет себя в газовой смеси так, как будто он один при температуре смеси 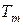 равномерно распространен во всем объеме смеси
равномерно распространен во всем объеме смеси 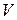 и развивает при этом давление, которое называется парциальным
и развивает при этом давление, которое называется парциальным  .
.
Уравнения состояния для i -го компонента и всей смеси идеальных газов могут быть представлены в следующем виде:
 =
= 
 ; (210)
; (210)
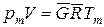 . (211)
. (211)
При делении уравнения (210) на уравнение (211) получаем
 . (212)
. (212)
Из соотношения (212) следует, что парциальное давление i -го компонента  в смеси идеальных газов определяется через полное давление смеси
в смеси идеальных газов определяется через полное давление смеси 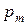 и молярную концентрацию компонента
и молярную концентрацию компонента 
 . (213)
. (213)
После преобразования соотношения (213) получаем, что сумма парциальных давлений всех компонентов смеси идеальных газов равна полному давлению смеси
 =
=  =
=  =
= 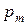 . (214)
. (214)
Поскольку внутренняя энергия и энтальпия идеального газа - функции только температуры, исходными соотношениями для определения средней температуры смеси идеальных газов 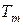 служат следующие соотношения:
служат следующие соотношения:
в схеме смешения при 
 ; (215)
; (215)
в схеме смешения при 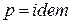
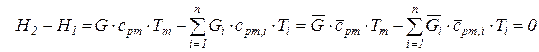 . (216)
. (216)
С учетом этих соотношений (215), (216) получаем обобщенное выражение по определению средней температуры смеси идеальных газов 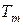 для различных схем смешения
для различных схем смешения
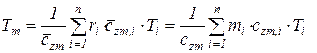 , (217)
, (217)
где  – массовая и молярная концентрации i- го компонента смеси;
– массовая и молярная концентрации i- го компонента смеси; 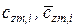 – средние удельные массовая и молярная теплоемкости i- го компонента смеси в процессах
– средние удельные массовая и молярная теплоемкости i- го компонента смеси в процессах  (
( );
);  – средние удельные массовая и молярная теплоемкости смеси,
– средние удельные массовая и молярная теплоемкости смеси,
 , (218)
, (218)
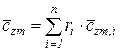 . (219)
. (219)
Объемная концентрация каждого компонента в смеси  определяется как отношение приведенного объема vi,пр компонента при давлении и температуресмеси к объему всей смеси v при тех же условиях
определяется как отношение приведенного объема vi,пр компонента при давлении и температуресмеси к объему всей смеси v при тех же условиях
 . (220)
. (220)
Для идеального газа, исходя из уравнения состояния
vi,пр = 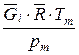 , v =
, v =  . (221)
. (221)
После подстановки vi,пр и V в соотношение (220) получаем
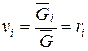 . (222)
. (222)
Отсюда следует, что для смесей идеальных газов объемная и молярная концентрации компонентов численно равны.
|
|
Дата добавления: 2015-05-09; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!