
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образец решения некоторых задач
|
|
|
|
1. Следствие из закона Гесса: 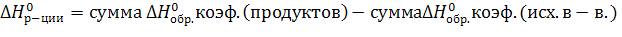
Любая реакция:
исходные вещества → продукты.
Пример. Какой реакции соответствует расчетная формула, выведенная из закона Гесса и его следствий:

С и D – продукты; А и В – исходные вещества; α – коэффициент перед В.
Это соответствует реакции A+αB→C+D
2. 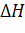 – энтальпия, Q – теплота
– энтальпия, Q – теплота
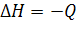 , если Q<0, то теплота поглощается
, если Q<0, то теплота поглощается
Если Q>0, то теплота выделяется
Пример 1. Чему равно изменение энтальпии в ходе реакции:

Если при сгорании 12,8 г. спирта выделяется 290,8кДж теплоты?
1) Рассчитаем количество моль вещества:
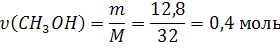
2) По уравнению реакции составляем пропорцию:

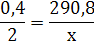

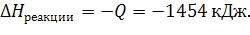
Пример 2. Вычислите, какое количество теплоты выделится при взаимодействии бромоводорода с кислородом, если израсходовалось 58,24 л бромоводорода?
1) Записываем уравнение реакции:
4HBr (г.) + O2(г.) = 2H2O(г.) + 2Br2(г.)
2) Пользуясь справочными данными вычисляем по следствию из закона Гесса (изменение энтальпии реакции равно разности между суммой энтальпий образования продуктов с учетом коэффициентов перед веществами и суммой энтальпий образования исходных веществ с учетом коэффициентов перед веществами) ∆Hреакции :
∆Hреакции = [2 ∆H ° обр.(H2O(г.)) + 2∆H ° обр(Br2(г.) )] --- [ 4∆H ° обр(HBr (г.) ) + ∆H ° обр (О2(г.))] =
[ 2(- 241,81) + 2(30,91)] --- [ 4(-36,38) + 0 ] =
(- 483,62 + 61,82) – (-145,52) = - 421,8 + 145,52 = - 276,28 кДж
3) Исходя из первого начала термодинамики:
Qреакции = – ∆Hреакции = - (- 276,28 кДж) = 276,28 кДж
4) Рассчитаем количество моль вещества:
V 58,24
υ (HBr) = -------- = --------- = 2,6 моль
VM 22,4
5) Записываем термохимическое уравнение и по уравнению реакции составляем пропорцию:
4HBr (г.) + O2(г.) = 2H2O(г.) + 2Br2(г.) + 276,28 кДж
2,6 х 2,6 ∙ 276,28
------ = --------------; х =Q = ----------------- = 179,582 кДж
4 276,28 4
3. Энтропия (S) мера беспорядка, →
а) Sгазов>Sжидкостей(растворов)>Sтвердых(кристаллов)
Если в правой части уравнения число моль газов > чем в левой части, то 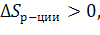
т.е. увеличивается, т.е. энтропия продуктов реакции больше энтропии исходных веществ.
Если в правой части уравнения число моль газов < чем в левой части, то  ,
,
т.е. уменьшается, т.е. энтропия продуктов < энтропии исходных веществ.
Если в правой части уравнения число моль газов = числу в левой части, то 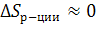 ,
,
т.е. практически остается постоянной, т.е. энтропия продуктов ≈ энтропии исх. веществ.
Если газов в реакции нет, то аналогично считаем по числу моль растворов (жидкостей).
Пример 1. Не производя вычислений, установите знак ∆Sреакций .
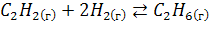
1+2=3 моль газов 1 моль газов
Газов в правой части < чем в левой, →  , уменьшается.
, уменьшается.

1+0=1 моль газов 0 моль газов
Газов в правой части < чем в левой,  , уменьшается
, уменьшается
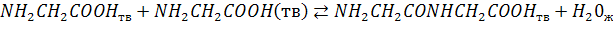
0+0=0 газов и жидкостей 0+1=1 жидкостей
Жидкостей в правой > чем в левой,  , увеличивается
, увеличивается

6 моль газов 6 моль газов
6 жидкостей 1 жидкостей
В правой части жидкостей < чем в левой,  , уменьшается
, уменьшается

1+1=2 моль газов 2 моль газов
В правой = в левой,  , практически не изменяется
, практически не изменяется

2 моль газов 1+3=4 моль газов
в правой газов > чем в левой, 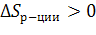 , увеличивается
, увеличивается
Пример 2. Расположите состояния воды (H2O) в порядке увеличения (↑) энтропии.
Если увеличить (↑) температуру (T), то энтропия (S) возрастает (↑).
Если увеличить (↑) давление (Р), то энтропия(S) убывает (↓)
1) H2O(ж) T=273K P=1 атм. S1
2) H2O(к) T=273K P=1 атм. S2
3) H2O(ж) T=373K P=1 атм. S3
4) H2O(г) T=373K P=1 атм. S4
5) H2O(г) T=400K P=1 атм. S5
6) H2O(г) T=400K P=0,5 атм. S6
В порядке увеличения энтропии:
S2<S1<S3<S4<S5<S6,
т.к. Sгазов>Sжид.>Sтверд. и если ↑Т, то S↑, если ↑P (давление), то S↓
4. Реакция протекает, если 
Не протекает, если 
 – энергия Гиббса, свободная энергия, изобарно-изотермический потенциал
– энергия Гиббса, свободная энергия, изобарно-изотермический потенциал
 (максимально полезная работа)
(максимально полезная работа)
Чем меньше  , тем наиболее вероятно протекание реакции
, тем наиболее вероятно протекание реакции
Чем меньше  , тем менее устойчивы исходные вещества и более устойчивы продукты
, тем менее устойчивы исходные вещества и более устойчивы продукты
Чем меньше  , тем исходные вещества в большей степени проявляют свои характерные свойства
, тем исходные вещества в большей степени проявляют свои характерные свойства
Пример. Какие оксиды можно восстановить углем?
а) 
б) 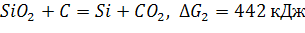
в) 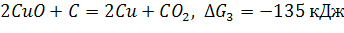
г) 
а и б – реакции не протекают, т.к. оксиды 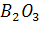 и
и 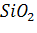 нельзя восстановить углем.
нельзя восстановить углем.
в и г – реакции протекают, т.к. оксиды CuO и PbO можно восстановить углем.
Для а и б: наиболее устойчивы исходные вещества, менее устойчивы продукты.
Для в, г: наиболее устойчивы продукты, менее устойчивы исходные вещества
Для в, г – менее устойчив CuO, чем PbO, т.е. CuO проявляет большие окислительные свойства, чем PbO.
5. Энтальпия образования сложного вещества ( , если в реакции получается 1 моль вещества (и никаких других) из простых веществ в устойчивых аллотропных и агрегатных состояниях, т.е. для тех простых веществ., для которых
, если в реакции получается 1 моль вещества (и никаких других) из простых веществ в устойчивых аллотропных и агрегатных состояниях, т.е. для тех простых веществ., для которых  =0.
=0.
Пример. Определите, энтальпии какой реакции соответствует 
1) 
2) 
3) 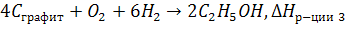
4) 
5) 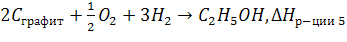
6) 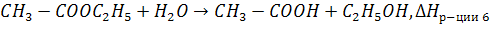
6-ая реакция не подходит, т.к. кроме  образуется еще и другое вещество
образуется еще и другое вещество
3-я реакция не подходит, т.к. получается 2 моль  , а не 1 моль.
, а не 1 моль.
4 реакция не подходит, т.к. 1 моль  получается не из простых веществ.
получается не из простых веществ.
1 реакция не подходит, т.к. O3 – простое вещество, но это неустойчивая аллотропная модификация
2 реакция не подходит, т.к. C(алмаз) – простое вещество, но неустойчивая аллотропная модификация
5 реакция подходит, т.к. исходные вещества – простые вещества и взяты в устойчивых аллотропных модификациях, следовательно 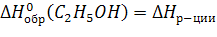 5
5
6. 
если  =0, то 0=
=0, то 0= 
В системе равновесие в тот момент реакции, когда существуют и исходные вещества, и продукты.
Пример 1. Рассчитайте  реакции:
реакции:
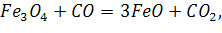
Если 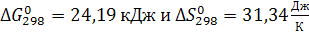
Нужно перейти к одинаковым единицам измерения.
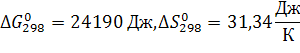
Или 
 , т.к. T не указано, то берем стандартное условие, Т=298К.
, т.к. T не указано, то берем стандартное условие, Т=298К.
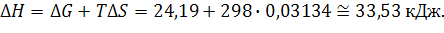
Пример 2. При какой температуре становится возможной реакция восстановления TiO2 углеродом, если
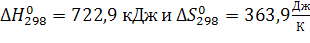

Реакция возможно либо выше, либо ниже Tравн., , если 
т.е. 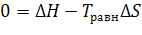

Т.к. ∆ H реакции > 0 и ∆Sреакции > 0, то реакция протекает при высоких температурах,
т.е. при температурах выше Т равновесия .
Восстановление TiO2 возможно при температурах выше 1986,5 К.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1775; Нарушение авторских прав?; Мы поможем в написании вашей работы!