
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные физико-химические свойства металлов
|
|
|
|
| Металл | Fe | Со | Ni |
| Тип кристаллической решётки | Кубическая объёмно-центрированная | Гексагональная | Кубическая гранецентрированная |
| Плотность, r, г/см3 | 7,874 | 8,84 | 8,90 |
| Температура плавления, оС | |||
| Стандартный электродный потенциал процессов Ео, В: Э2+ + 2е → Э Э3+ + 3е → Э | –0,440 –0,036 | –0,277 0,4 | –0,250 – |
Отношение триады железа к кислороду и другим неметаллам. Железо, кобальт и никель – металлы средней химической активности. Химическая активность в ряду Fe ® Co ® Ni постепенно снижается, поэтому кобальт и никель менее реакционноспособны, чем железо, и проявляют стойкость к коррозии на воздухе, в воде и в различных растворах при обычной температуре.
В компактном состоянии химически чистое железо коррозионно устойчиво. Техническое железо, содержащее различные примеси, под действием влажного воздуха, диоксида углерода и кислорода в короткий срок покрывается ржавчиной, примерный состав которого выражается формулой: Fe2O3 · хH2O.
Ржавчина не предохраняет железо от дальнейшей коррозии, так как обладает рыхлой и пористой структурой и не препятствует возникновению поверхностных микрогальванопар.
Железо окисляется до Fe2+, который во влажной атмосферебыстро окисляется до трёхвалентного. Схема суммарного процесса:
4Fe(т) + О2(г) + 2Н2О(ж) →2 Fe2O3хH2O(т)
При комнатной температуре железо окисляется медленно, но при температуре красного каления легко взаимодействует с кислородом, галогенами, серой, фосфором, кремнием, бором, и другими неметаллами, образуя, соответственно, галогениды, сульфиды, фосфиды, силициды, бориды. В зависимости от условий и активности неметалла образуются твёрдые растворы (с С, Si, N, B, P, H), металлоподобные (Fe3C, Fe3Si, Fe3P, Fe4N, Fe2N) и солеподобные (FeF3, FeCl3, FeS) соединения.
Скорость окисления кобальта и никеля ниже, тем не менее, они тоже окисляются кислородом до монооксидов, особенно в мелкораздробленном состоянии. В мелкораздробленном состоянии эти металлы пирофорны – способны самовоспламеняться на воздухе.
С азотом Fe, Co и Ni непосредственно не соединяются, но косвенным путём можно получить разнообразные бинарные соединения, называемые нитридами.
С водородом эти металлы (как и все d -элементы) не образуют гидридов определённого состава, но они растворяют водород как в твёрдом, так и в расплаве. Наибольшей растворяющей способностью обладают никель, платина и палладий, которые используют в процессах гидрирования–дегидрирования органических соединений.
Отношение металлов к воде, кислотам, щелочам. Железо не реагирует с водой при обычных условиях, но при нагревании выше 500 оС разлагает пары воды:
4H2O(г) + 3Fe(т) ↔ Fe3O4(т) + 4H2(г).
Разбавленные кислоты, анионы которых не обладают окислительными свойствами (HCl, H2SO4), растворяют железо и кобальт при обычной температуре, а никель – при нагревании, с образованием солей 2-х валентных металлов:
Fe0(т) + 2H+(в) ® Fe2+(в) + H2(г).
Кислоты – окислители при нагревании окисляют железо до Fe(III):
Fe(т) + 4HNO3конц.  Fe(NO3)3(в) + NO(г) + 2H2O(ж)
Fe(NO3)3(в) + NO(г) + 2H2O(ж)
2Fe(т) + H2SO4конц.  Fe2(SO4)3(в) + 3SO2(г) + H2O(ж).
Fe2(SO4)3(в) + 3SO2(г) + H2O(ж).
При действии достаточно разбавленной азотной кислоты на холоду железо окисляется до Fe(III) максимально восстанавливая нитрат – ион:
4Fe(т) + 10HNO3разб. ® 4Fe(NO3)3(в) + NH4NO3(в) + 3H2O(ж).
Концентрированные HNO3, H2SO4 и H2CrO4 на холоду пассивируют эти металлы и растворения их не происходит.
Железо взаимодействует с концентрированными растворами щелочей; разбавленные щёлочи действуют на железо только в присутствии СО2. Кобальт и никель со щелочами практически не взаимодействуют.
Соединения Fe, Co и Ni (0). Нулевую степень окисления Fe, Co и Ni проявляют в карбонилах: Fe(CO)5 (жёлтая летучая жидкость), Cо2(CO)8 (оранжевые кристаллы), Ni(CO)4 (бесцветная летучая жидкость), нитрозилах и других соединениях. Все они очень ядовиты, практически нерастворимы в воде, растворимы в органических растворителях.
Карбонилы получают действием монооксида углерода – СО на порошкообразные металлы при нагревании и повышенном давлении:
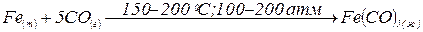 .
.
Соединения Fe, Co и Ni (II). Для Fe, Co и Ni известны многочисленные соединения со степенью окисления +2: оксиды, гидроксиды, соли, комплексные соединения.
Оксиды. FeO (черный), CoO (серо-зеленый), NiO (зеленый) практически не растворимы в воде и щелочах, легко растворимы в кислотах, т.е. обладают основными свойствами. Они получаются разложением гидроксидов, солей летучих кислот, окислением металлов и другими способами.
Гидроксиды. Fe(OH)2 (белый), Co(OH)2 (розовый), Ni(OH)2 (зеленый) нерастворимы в воде, могут быть получены косвенным путём –действием щелочей на растворимые соли:
Э2+(в) + 2ОН-(в) ® Э(ОН)2 ¯.
Гидроксиды Fe(II), Co(II) и Ni(II) легко растворяются в кислотах, проявляя основные свойства. Их амфотерность выражена очень слабо: только действием сильно концентрированных растворов щелочей удается получить Na2[Fe(OH)4] ּ 2H2O и Na2[Co(OH)4].
В отличие от гидроксидов других d- элементов гидроксиды железа Fe(OH)2 и Fe(OH)3 не растворяются в аммиаке. Гидроксиды Со(ОН)2 и Ni(OH)2 легко растворяются в растворе аммиака с образованием комплексных катионов – [Э(NH3)6]2+. Ni(OH)2 устойчив по отношению к кислороду. Со(ОН)2 медленно окисляется, образуя черный гидроксид Со(ОН)3, а Fe(OH)2, подобно Mn(OH)2, быстро окисляется на воздухе, образуя Fe(OH)3 буро-красного цвета:
4Fe(OH)2(т) + O2(г) + 2H2O(ж) = 4Fe(OH)3(т)
Следовательно, восстановительные свойства ослабевают в ряду
Fe (II) → Co (II) → Ni (II);
Fe2+– достаточно сильный восстановитель и легко окисляется кислородом воздуха, тогда как Со3+ настолько сильный окислитель, что окисляет даже воду:
4Со3+(в) + 2H2O(ж) → 4Со2+(в)+ 4Н+(в) +О2(г).
Соли. Соли железа (II) и сильных кислот хорошо растворимы в воде.
К труднорастворимым солям относятся карбонаты, фосфаты, сульфиды и другие соли слабых кислот. Соли Fe(II) получают растворением в разбавленных неокисяющихся кислотах металлического железа, оксида или гидроксида двухвалентного железа, а также восстановлением солей Fe(III).
Наибольшее практическое значение имеют FeSO4 ּ 7H2O, FeCO3, FeS, FeCl2. Бледно-зеленые кристаллы FeSO4 ּ 7H2O при хранении на воздухе постепенно выветриваются, причем Fe(II) частично окисляется до Fe(III):
4FeSO4(в) + O2(г) + 2H2O(ж) = 4Fe(OH)SO4(в).
Подобное отношение к кислороду воздуха характерно и для других солей Fe(II), в отличие от солей Co(II) и Ni(II).
Соединения Fe(II) используются в химическом анализе в качестве восстановителей:
10FeSO4(в)+2KMnO4(в)+8H2SO4(в)=2MnSO4(в)+5Fe2(SO4)3(в)+K2SO4(в)+8H2O(ж)
Обычно вместо FeSO4 ·7H2O применяют более устойчивую к окислению на воздухе двойную соль Мора – (NH4)2Fe(SO4)2 ·6H2O.
Соли Fe(II), Co(II) и Ni(II) в водных растворах гидролизуются, образуя в зависимости от условий продукты различного состава, в том числе полиядерные комплексы.
Сероводород (H2S) и растворимые сульфиды осаждают из растворов солей Fe2+, Co2+ и Ni2+ нерастворимые черные осадки сульфидов FeS, CoS, NiS, растворимые в разбавленных кислотах (свежеосаждённые).
Для катионов Fe2+, Co2+ и Ni2+ весьма характерно образование комплексных соединений, как катионного, так и анионного типа с координационными числами: 6 – Fe 2+, 6 и 4 – Со 2+ и Ni 2+. Имея от 6 до 8 электронов на d- орбиталях, они формируют комплексы с внешней и внутренней гибридизацией, в зависимости от силы лиганда. В случае внешней гибридизации (слабое поле лигандов) комплекс является более реакционноспособным. Примеры катионных комплексов: а) аквакомплексы – [Fe(H2O6]Cl2, б) аминокомплексы – [Fe(NH3)6]Cl2 – внешняя гибридизация; анионных: – а) ацидокомплексы – H4[Fe(CN)6] – внутренняя, H2[CoCl4] – внешняя гибридизации, б) гидроксокомплексы – Na4[Fе(OH)6] – внешняя гибридизацияи. Комплексы с координационным числом 6 имеют октаэдрическую конфигурацию в пространстве, с координационным числом 4 – либо плоскоквадратное, либо тетраэдрическое строение.
В водных растворах образуются октаэдрические аквакатионы [Э(Н2О)6]2+, сохраняющие свою конфигурацию в высших кристаллогидратах солей:
FeSO4 · 7H2O, CoCl2 · 6H2O, Co(NO3)2 · 6H2O и других.
Аквакомплексы ионов, имеющих незавершенную 18-электронную наружную оболочку, окрашены:
Fe2+ – слабо зеленый, Со2+ – розовый, Ni2+ – зеленый.
Из анионных комплексов наиболее устойчивыми и легко образующимися являются цианидные комплексы. В аналитической практике широко применяется желтая кровяная соль – гексацианоферрат(II) калия – K4[Fe(CN)6] ּ 3H2O для обнаружения ионов Fe3+:
FeCl3(в) + K4[Fe(CN)6] (в) = KFe(Fe(CN)6] (т) + 3KCl(в)
берлинская лазурь (синего цвета)
Широко используется ферроцен – пентадиенил Fe(II) – Fe(С5Н5)2 – интересный своим строением.
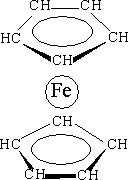
| В этом соединении d-элемент расположен между двумя углеводородными циклами, образующими с ним p-связи (Р. Вудворд, 1952 г.). Этот тип соединений d-элементов с органическими молекулами назван сэндвичевыми соединениями. Открытие их строения было огромным вкладом в развитие структурной химии и теории химической связи. Установлено, что в ферроцене простые и двойные связи циклов С5Н5 усреднены, как в бензоле, что обозначают кольцевым символом внутри цикла. |
 Особенность строения ферроцена состоит в том, что атом металла взаимодействует не с одним конкретным атомом углерода, а сразу со всеми атомами углерода двух органических молекул. Орбитали р -электронов, принадлежащих циклам, перекрываются друг с другом и с незанятыми
Особенность строения ферроцена состоит в том, что атом металла взаимодействует не с одним конкретным атомом углерода, а сразу со всеми атомами углерода двух органических молекул. Орбитали р -электронов, принадлежащих циклам, перекрываются друг с другом и с незанятыми
d -орбиталями металла. Возникает комплексное соединение, где в образовании связи с атомом железа принимают участие все р -электроны циклопентадиенильных колец, образуя с металлом координационные связи. Это самостоятельный тип химической связи, получивший название p-комплексной связи. Хорошо изученными биокомплексами железа с порфиринами являются гемоглобин и миоглобин, осуществляющие в живых организмах важнейший биохимический процесс – потребление кислорода.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две других координационных позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина. Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64 положении цепи. Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы.
Гемоглобин в легких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и моноксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образует карбоксигемоглобин.
Для кобальта известны аквакомплексы розового цвета с координационным числом 6 (высокоспиновые октаэдрические ионы) и синего цвета – с координационным числом 4. В тетраэдрическом поле лигандов энергия расщепления d -орбиталей меньше и полоса поглощения иона Со2+ смещается в сторону больших длинных волн, окраска изменяется от розовой в синюю. Процесс обезвоживания розового кристаллогидрата CoCl2 ּ 6H2O протекает через стадии образования кристаллогидрата цветов персика CoCl2 ּ 4H2O, розово-фиолетового CoCl2 ּ 2H2O, тёмно-сине-фиолетового CoCl2 ּ 1,5H2O, синефиолетового CoCl2 ּ H2O и до бледно-голубого порошка CoCl2. На этом явлении основано применение хлорида кобальта для приблизительного определения влажности воздуха.
При добавлении к раствору хлорида кобальта концентрированной соляной кислоты или хлоридов кальция и магния появляется синяя окраска за счёт образования высокоспинового тетраэдрического аниона [CoCl4]2-.
При взаимодействии насыщенных растворов CoCl2 и NH4CNS образуется (NH4)2[Co(CNS)4] ярко-синего цвета, экстрагируемый амиловым спиртом и другими органическими растворителями. В водном растворе он неустойчив и синяя окраска переходит в розовую, характерную для аквакомплекса [Co(H2O)6]2+ (аналитическая реакция Со2+).
Из анионных комплексов Ni(II) наиболее устойчив [Ni(CN)4]2-, получаемый действием цианидов щелочных металлов на соединения двухвалентного никеля. Вначале выпадает осадок Ni(CN)2, который растворяется в избытке цианида:
NiSO4(в) + 2KCN(в) = Ni(CN)2(т) + K2SO4(в)
Ni(CN)2(т) + 2KCN(в) = K2[Ni(CN)4] (в)
Тетрацианониколлат (II) калия
Довольно легко образуются николлаты (II) типа: М4+[NiГ6] (где Г – галоген), М4+[Ni(SCN)6] и другие.
Катион Ni2+ образует интенсивно окрашенные соединения с многочисленными органическими лигандами, содержащими оксимную группу –
N–OH. Диметилглиоксим (реактив Чугаева) с Ni2+ образует в аммиачной среде хелатное соединение красного цвета, выпадающее в осадок из концентрированных растворов:
 H3C – C C – CH3
H3C – C C – CH3
H3C – C = N – OH +2NH3 ® O N N – O
H H + 2NH4+
Ni2+ + 2H3C – C = N – OH Ni
O – N N O
H3C – C C – CH3
Это качественная реакция на никель(II) (реакция обнаружения).
Соединения Fe, Co и Ni (III). Оксиды и гидроксиды. Из оксидов состава Э2О3 при обычных условиях устойчив лишь Fe2O3. Буро-красный порошок Fe2O3 получают термическим разложением гидроксида железа (III); он не растворяется в воде, используется в качестве пигмента в минеральных красках «охра», «мумия», «сурик железный» и других.
Fe2O3 проявляет амфотерные свойства с преобладанием основных. Он образует соли железа (III) при растворении в кислотах и при сплавлении со щелочами или карбонатами:
Fe2O3(т) + 6HCl(в) = 2FeCl3(в) + 3H2O(ж)
Fe2O3(т) + Na2CO3(т) = 2NaFeO2(т) + CO2(г)
феррат (III) натрия
(соль железистой кислоты HFeO2)
Гидроксиды Э(ОН)3 получены для всей триады элементов. Формула Э(ОН)3 условна, для слабых гидроксидов более правильно выглядит
Э2О3 · nН2О.
Fe(OH)3 получается при действии щелочей или раствора аммиака на соли железа (III):
FeCl3(в) + 3NH3(в) + 3H2O(ж) = Fe(OH)3(т) + 3NH4Cl(в).
Fe(OH)3 – аморфный красно-бурый осадок, по свойствам похож на Al(OH)3. Легко растворяется в разбавленных кислотах, вступая в реакцию солеобразования. Свежеосажденный гидроксид железа (III) растворяется в горячих концентрированных растворах щелочей также с образованием соли:
Fe(OH)3(т) + 3KOH(в) = K3[Fe(OH)6](в) .
Гидроксид кобальта (III) получают окислением Со(ОН)2:
2Co(OH)2(т) + H2O2(в) = 2Co(OH)3(т);
2Co(OH)2(т) + NaOCl(в) + H2O(ж) = 2Co(OH)3(т) + NaCl(в).
Черный Ni(OH)3 получают действием очень сильных окислителей на Ni(OH)2 в щелочной среде:
2Ni(OH)2(т) + Br2(ж) + 2KOH(в) ® 2Ni(OH)3(т) + 2KBr(в).
Амфотерные свойства Со(ОН)3 и Ni(OH)3 выражены еще слабее, чем у Fe(OH)3. В ряду Fe(OH)3 – Со(ОН)3 – Ni(OH)3 усиливаются основные и окислительные свойства. Со(ОН)3 и Ni(OH)3 являются сильными окислителями, особенно в кислой среде:
2Co(OH)3(т) + 6HCl(в) = CoCl2(в) + Cl2(г) + 6H2O(ж).
На окислительной способности Ni(OH)3 основано его применение в щелочных аккумуляторах.
Соли. Соли Fe (III) и сильных кислот растворимы в воде, в водных растворах они гидролизуются в большей степени, чем соли Fe (II) и образуют различные полиядерные комплексы. Начальные стадии гидролиза представлены схемой:
[Fe(OH2)6] 3+(в) + H2O(ж) = [Fe(OH2)5OH]2+(в) + OH3+(в)
[Fe(OH2)5OH]2+(в) + H2O(ж) = [Fe(OH2)4(OH)2]+ (в) + OH3+(в)
 2[Fe(OH)6]3+(в)+ 2H2O = H2O H2O 2+ + 2OH3+
2[Fe(OH)6]3+(в)+ 2H2O = H2O H2O 2+ + 2OH3+
H2O H OH2
O
НО –Fe Fe – ОН
O
H2O H OH2
H2O H2O
В результате последующей полимеризации гидроксоаквакомплексов (особенно при нагревании) образуются многоядерные комплексы, производные которых выделяются из растворов в коллоидном состоянии. В итоге выпадает осадок Fe2O3·nH2O в виде красно-коричневой студенистой массы.
Аквакомплекс [Fe(OH)6]3+ окрашен в желтый цвет, однако, вследствие наличия продуктов гидролиза, водные растворы солей железа (III) окрашены в бурый цвет.
С сульфатами щелочных металлов и аммония ион Fe3+ образует двойные соли – квасцы: бледно-фиолетовые железо-калиевые KFe(SO4)2·12H2O, бесцветные железоаммониевые NH4Fe(SO4)2·12H2O.
Соединения Fe (III), Co (III), Ni (III) проявляют окислительные свойства:
2FeCl3(в) + 2KI(в) = 2FeCl2(в) + I2(т) + 2KCl(в)
Поэтому H2S и сульфиды из растворов Fe (III), Co (III), Ni (III) осаждают смесь сульфидов и серы, а не стехиометрическое соединение Э2S3.
Много комплексных соединений образует Сo (III), меньше – Fe (III) и совсем мало Ni (III).
Замечено, что соли Со (II) устойчивы и многочисленны, а комплексные соединения редки и неустойчивы. Для Со (III) характерно обратное явление – обычные соли редки и неустойчивы (легко разлагаются, превращаясь в соли Co (II)), а комплексные соединения устойчивы и многочисленны. Особенно прочны комплексы Co3+ (d5 – конфигурация) с лигандами: NH3, CN-, CNS-, а также с H2O, NO2-, OH-, NO3-, SO42-. Большинство комплексных соединений окрашено.
Комплексный анион [Co(NO2)6]3– с катионами К+, Rb+, Cs+ образует малорастворимые в воде осадки состава Me3[Co(NO2)6]. Образование желтой соли K3[Co(NO2)6] используется для обнаружения ионов калия в растворе.
Аммиакаты Fe (III) типа [Fe(NH3)6]3+ еще менее устойчивы, чем аммиакаты Fe (II). Они полностью разлагаются водой.
Анионные комплексы Fe (III) более устойчивы, чем комплексы Fe (II). Наиболее устойчив гексацианоферрат (III) – [Fe(CN)6]3-. Наибольшее значение в практике имеет красная кровяная соль K3[Fe(CN)6]. Эта соль является реактивом на Fe+2, т.к. образует с ним интенсивно синий малорастворимый гексацианноферрат (III) калия-железа (II), который называют турнбуллевой синью:
FeCl2(в) + K3[Fe(CN)6](в) = KFe[Fe(CN)6] (т) + 2 KCl(в)
Fe+2(в) + K+(в) + [Fe(CN)6]3-(в) = KFe[Fe(CN)6](т).
Известен ряд комплексных соединений состава Men[Fe(CN)5Х], в которых имеется 5 ионов (CN)-, а шестой замещен другим отрицательным ионом или нейтральной молекулой СО, NO. Они окрашены в фиолетово-красный или рубиново-красный цвет. Такие соединения носят общее название пруссидов. Гигроскопичные токсичные красные кристаллы нитрпруссида калия K2[Fe(CN)5NO], устойчивые на воздухе, получают:
K4[Fe(CN)6](в) + KNO2(в) + H2O(ж) = K2[Fe(CN)5NO](т) + KCN(в) + 2KOH(в).
Нитропруссид калия является реактивом на ионы S2- (красно-фиолетовое соединение ) и SO32- (розово-красная окраска).
Соединения железа (VI). Для железа, в отличие от кобальта и никеля, известны соединения, в которых степень окисления его равна +6. Так, при сплавлении железных опилок (или Fe2O3) с KNO3 и KOH образуется сплав, содержащий калиевую соль железной кислоты, называемую ферратом калия K2FeO4:
Fe2O3(т) + 4KOH(т) + 3KNO3(т) = 2K2FeO4(т) + 3KNO2(т) + 3H2O(г).
При растворении в воде получается красно-фиолетовый раствор, из которого под действием BaCl2 осаждается нерастворимый в воде феррат бария:
K2FeO4(в) + BaCl2(в) = BaFeO4¯ + 2KCl(в).
Ферраты – соединения непрочные и являются сильными окислителями (более сильные, чем перманганаты).
В организме человека содержится около 5 г железа (0,007 %) и 1,2 г кобальта. Суточное потребление железа 10 – 20 мг, кобальта – 0,3 мг.
Fe, Co и Ni, являясь необходимыми для процессов жизнедеятельности микроэлементами, содержатся в активных центрах ферментов (карбоангидразы, киназы, алкогольдегидрогеназы – кобальт (II), каталазы, пероксидазы – железо (II), фосфоглюкомитазы – никель (II)). Железо входит в состав гемоглобина, миоглобина, цитохромов. Гемоглобин представляет собой железо (II) порфириновый комплекс, связанный с белком (обусловливает красный цвет крови). Гемоглобин обратимо связывает кислород и переносит его из легких к мышцам, после чего связывает СО2 и транспортирует его в легкие. Миоглобин обеспечивает запас кислорода в мышцах в связанном виде. Миоглобин, цитохромы, каталаза обеспечивают клеточное дыхание. Каталаза – железосодержащий металлофермент – контролирует разложение пероксида водорода в организме, способствуя сохранению важнейших составных частей клетки – мембраны и ДНК.
Цитохром-В– и цитохром-С–оксидаза участвуют в переносе электронов. Ферредоксины – белки, в которых железо непосредственно связано с белками – участвуют в окислительно-восстановительных процессах дыхания. Трансферрины – белки, содержащие железо негемовой природы. Транспорт железа, кобальта и никеля в организмах осуществляется в виде комплексов этих металлов с белками или их ферментами. В тканях присутствует несколько негемовых железосодержащих белковых комплексов – оксидазы и белки – накопители и переносчики железа. Избыток железа переносится с кровью белком – трансферрином и накапливается в виде железосодержащего белка – ферритина в печени, селезёнке, костном мозге. Присутствие (запас) атомов железа обеспечивает многочисленные реакции метаболизма с участием этого элемента.
При недостатке железа в организме развивается железодефицитная анемия (малокровие), понижается уровень клеточного дыхания, замедляется обмен веществ.
Кобальт также является одним из важнейших биогенных элементов. Около 100 мг его находится в виде цианкобаламина (жирорастворимого витамина В12) – представляющего собой комплекс двухвалентного кобальта с порфинами. витамин В12 наиболее важную роль играет в формировании эритроцитов, поэтому дефицит витамина приводит к тяжёлому заболеванию – злокачественной анемии.
Никель относится числу микроэлементов, биологическая роль которых изучена недостаточно. Известно, что он входит в состав многих растительных и животных организмов, стимулируя синтез аминокислот в клетке, ускоряя регенерацию белков плазмы крови, нормализуя содержание гемоглобина в больных организмах и выполняя ряд других важных функций.
Комплексные соединения железа K4[Fe(CN)6] и K3[Fe(CN)6] применяются в аналитической химии для качественного обнаружения Fe+2 и Fe+3 и примесей Zn+2 и Cu+2 в фармакопейных препаратах.
Хлорид железа (III) – FeCl3 используют в аналитической практике для установления подлинности органических лекарственных препаратов (анальгина, бутадиона, амидопирина, морфина, кофеина, фенола), которые образуют окрашенные комплексные соединения с ионами Fe+3.
Способность Fe(III), Co(II) и Ni(II) образовывать при рН > 7 окрашенные комплексные соединения с белками, пептидами и аминокислотами используется в биохимии.
Лекарственные препараты: железо(II) лактат и витамин В12 (цианокобаламин) используют для лечения малокровия и анемий.
В больших количествах соединения Со(II), Fe(III) и Ni(II) канцерогенны – в опухолях обнаружено их повышенное содержание.
Комплексные соединения платины применяются в современной медицине в качестве противоопухолевых препаратов. Платина и платиновые металлы используют для изготовления электродов, термопар и ответственных деталей приборов, используемых в медицинской практике. Однако некоторые соединения платиновых металлов являются высоко токсичными.
3.2. Контрольные вопросы и задания
1. Положение в Периодической Системе и строение атомов элементов VIIIB группы. Основные степени окисления железа, кобальта, никеля.
2. Химические свойства железа, кобальта никеля, способность к комплексообразованию.
3. Получение гидроксидов Fe, Co, Ni в различных степенях окисления. Их химический характер (кислотно-основные и редокс свойства).
4. Соли двух и трёхвалентного железа. Их растворимость и гидролизуемость.
5. Окислительно-восстановительные свойства соединений Fe, Co и Ni.
6. Комплексные соединения железа с тиоцианат- и цианид- ионами, порфиринами, аминокислотами и белками. Гемоглобин и железосодержащие ферменты. Строение и химизм их действия.
7. Ферраты, их получение и окислительные свойства.
8. Важнейшие комплексные соединения кобальта и никеля. Кофермент В12.
9. Химические основы применения железа, кобальта, никеля в медицине и фарманализе. Реакция Чугаева.
10. Платиновые металлы. Комплексные соединения платины (II) и (IV).
3.3. Индивидуальные задания
Задание. Решите задачи своего варианта (табл.16)
Таблица 16
Исходные данные
| Вариант | |||||||||||||||
| Номер задач | 1а | 1б | 13а | 13б | |||||||||||
| 14аб | 14вг | 14де | |||||||||||||
| 29а | 1а | 1б | |||||||||||||
| 29б | 29в | 29г | 30аб | 30бв |
1. Составьте таблицы свойств гидроксидов и охарактеризуйте изменение кислотно-основных и окислительно-восстановительных свойств в ряду:
а) Fe(OH)2 – Co(OH)2 – Ni(OH)2;
б) Fe(OH)3 – Co(OH)3 – Ni(OH)3.
2. Охарактеризуйте комплексообразующие свойства ионов железа, кобальта и никеля в различной степени окисления, составив таблицу.
3. Напишите электронные и электронно-графические формулы атомов железа, кобальта и никеля и ионов Fe+2, Fe+3, Co+2, Co+3, Ni+2, Ni+3.
4. Каким образом из металлического железа можно получить: а) соль железа (II); б) соль железа (III)? Напишите уравнения реакций.
5. Как получить гидроксиды железа, кобальта и никеля с разными степенями окисления ионов металлов?
6. Какой из ионов: Fe+2, Co+2 или Ni+2 является более сильным восстановителем? Приведите примеры реакций, в которых проявляется это различие.
7. Приведите уравнения качественных реакций на ионы Fe+2 и Fe+3.
8. Почему для получения водных растворов солей железа (III) прибавляют кислоту?
9. Какая соль железа сильнее подвергается гидролизу FeCl2 или FeCl3? Почему?
10. Как перевести соль железа (II) в соль железа (III)? Как осуществить обратный переход?
11. Какие комплексные соединения образуют Fe2+, Co2+, Ni2+ и Fe3+, Co3+, Ni 3 + ?
12. Какая из комплексных солей более устойчива [Co(NH3)6]Cl2 или [Co(NH3)6]Cl3? Почему? Проверьте, совпадает ли ответ со значением констант нестойкости данных комплексных тонов.
13. Составьте уравнения реакций, протекающих по схемам:
а. Fe(OH)2 ® Fe(OH)3 ® Fe2(SO4)3 ®KFe[Fe(CN)6]
б. Fe ® FeCl2 ® Fe(OH)2 ® K2FeO4 ® Fe2(SO4)3 ® FeSO4 ® KFe[Fe(CN)6]
Охарактеризуйте состояние реагирующих веществ.
14. Закончите уравнения следующих реакций:
а. FeSO4 + KMnO4 + H2SO4 ®
б. FeSO4 + NaClO3 + NaOH ®
в. Ni(NO)2 + NaClO + H2O ®
г. FeSO4 + H2O2 + H2SO4 ®
д. Ni(OH)2 + Br2 + H2O ®
е. Co(OH)2 + H2O2 ®
Охарактеризуйте состояние реагирующих веществ.
15. Составьте координационные формулы следующих соединений: 3KCN·Fe(CN)3; Co(NO3)2·6NH3; 2NH4NCS·Co(NCS)2; CoCl2·6H2O; NiSO4·6H2O.
16. Напишите формулы соли Мора и железо-аммониевых квасцов. Определите массовую долю железа в каждой из солей.
17. Рассчитайте, какой объем раствора соляной кислоты с массовой долей 10 % (r = 1,05 г/см3) потребуется для растворения 7,4 г железа?
18. Какой объем раствора дихромата калия с молярной концентрацией эквивалента 0,1 моль/дм3 необходим для взаимодействия с 3,0 г сульфата железа (II) в кислой среде?
19. Сколько FeSO4 содержится в 20 мл раствора, если на титрование его в кислой среде затрачено 24,6 мл раствора перманганата калия с молярной концентрацией эквивалента 0,01 моль/дм3?
20. Общая характеристика d- элементов VIIIB группы. Строение атомов, степени окисления, типы гибридизации.
21. Химические свойства железа, кобальта и никеля.
22. Оксиды и гидроксиды железа, кобальта, никеля, их химический характер. Кислотно-основные и окислительно-восстановительные свойства.
23. Растворимость и способность к гидролизу солей двух- и трёхвалентного железа.
24. Окислительно-восстановительные свойства соединений железа, кобальта и никеля.
25. Комплексные соединения железа с цианид- и тиоцианат- ионами, оксидом углерода, порфиринами и другими органическими веществами. Гемоглобин и железосодержащие ферменты. Химизм их действия.
26. Ферраты, их получение и свойства.
27. Важнейшие соединения кобальта и никеля.
28. Комплексные соединения кобальта и никеля. Витамин В12.
29. Осуществите превращения:
а. Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 →K2FeO4;
б. FeSO4 → Fe2(SO4)3 →K4[Fe(CN)6] → FeCl2 →FeCl3 → KFe [Fe(CN)6];
в. K3[Fe(CN)6] → FeCl3→FeCl2→ KFe [Fe(CN)6];
г. CoCl2 →Co(OH)Cl → Co(OH)2 → Co(OH)3.
30. Закончите уравнения реакций:
а. Ni(OH)2 + Br2 + H2O →;
б. FeSO4 +H2O2+ H2SO4 →;
в. Co(OH)2 +H2O2 →
31. Особенности строения атомов элементов VIIIB группы ПСЭ. Семейства железа и платиновых металлов.
32. Степени окисления, химические свойства Fe, Co и Ni.
33. Оксиды и гидроксиды железа, кобальта и никеля. Их химический характер (кислотно-основные и окислительно-восстановительные свойства).
34. Соли железа (II) и (III): растворимость, гидролиз.
35. Окислительно-восстановительные свойства соединений Fe, Co и Ni.
36. Комплексные соединения железа с цианид- и тиоцианат-ионами, оксидом углерода (II), порфиринами и другими органическими лигандами. Гемоглобин и железосодержащие ферменты, химизм их действия.
37. Ферраты, их получение и окислительные свойства.
38. Важнейшие соединения Со(II), Co(III) и Ni(II).
39. Комплексные соединения кобальта и никеля. Кофермент В12. Реакция Чугаева.
40. Применение соединений кобальта, железа никеля и платиновых металлов в медицине и фармации. Биологическая роль.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 4288; Нарушение авторских прав?; Мы поможем в написании вашей работы!