
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод Темкина-Шварцмана 1 страница
|
|
|
|
Дятел
Попил наш Язычок чаю с конфетой и вареньем и вдруг слышит, кто –то за окном стучит Ды – ды – ды – ды… Выглянул в окошко, а это дятел прилетел на дерево под окном и стучит своим клювом по коре. Стучит и прислушивается, где жучки прячутся под корой. И дятел стучит, то быстро, то медленно. Вот так. Рот широко открыт, язык поднят вверх, кончик упирается в альвеолы. Не роняя язык вниз, громко и медленно стучим кончиком по альвеолам: ды – ды – ды…. Следить, чтоб работал только кончик языка. На первых порах, пока ребенку трудно удерживать язык вверху и стучать по альвеолам, можно использовать палец ребенка. Кладем указательный палец поперек нижних зубов под поднятый язык. В таком положении язык не падает вниз и его кончик работает вверху. В дальнейшем палец убираем. Повторяем упражнение в течении 10 – 20 секунд до 30 раз в день.
Кто по дереву стучит
Дын – дын – дын,
Да дын – дын – дын?
Это дятел, добрый дятел
Постучи и ты за ним.
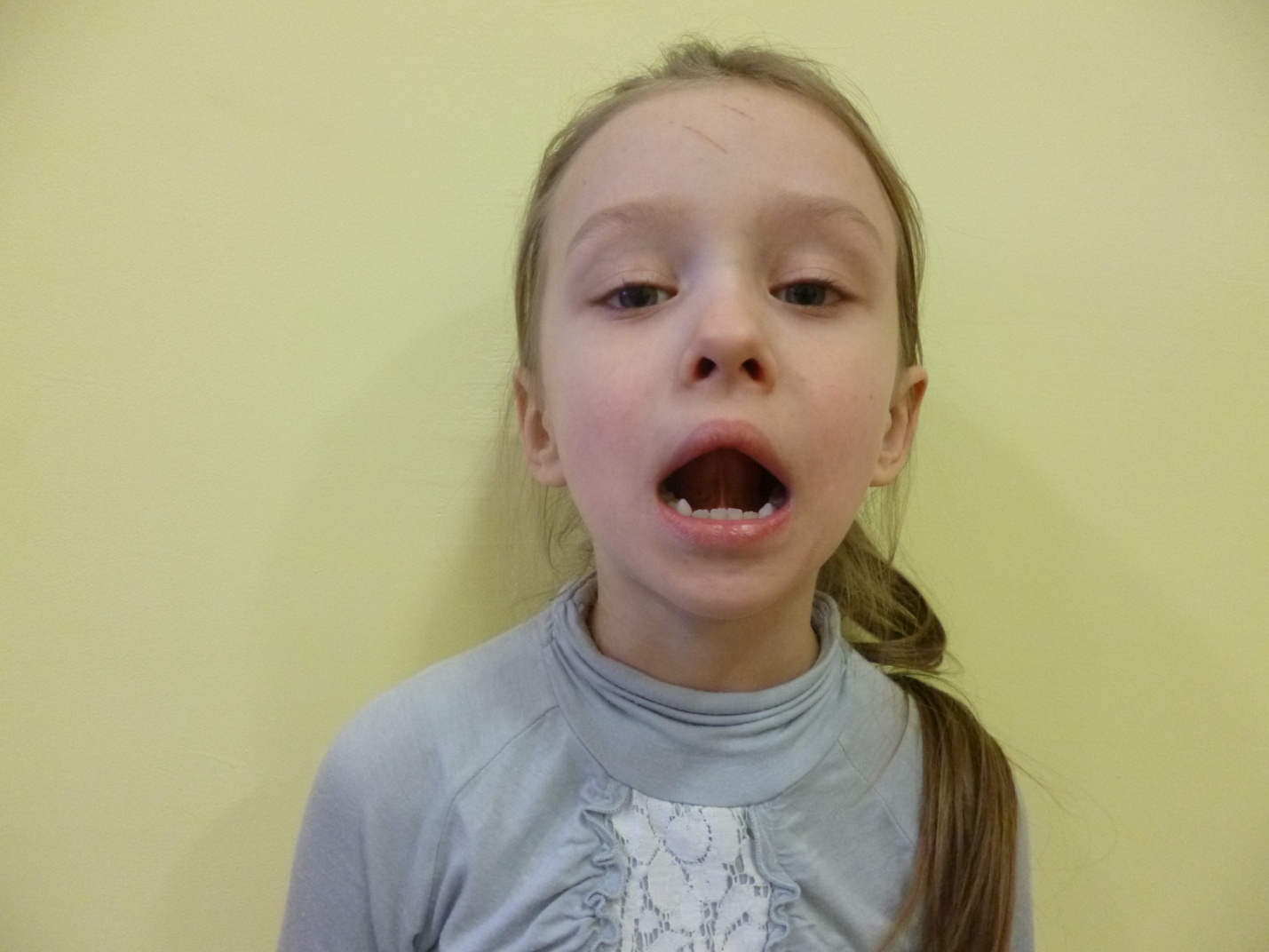
В справочных таблицах приводятся обычно D G 0 при температуре 298 К, но в большинстве случаев нужно рассчитывать равновесие для других температур.
Уравнение (5.40) можно записать в виде:
 (5.41)
(5.41)
Подставляя зависимость D Cp от температуры, выраженную уравнением 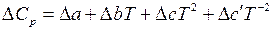 в уравнение (5.41), после интегрирования получим:
в уравнение (5.41), после интегрирования получим:
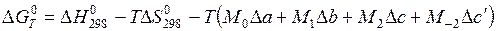 , (5.42)
, (5.42)
где M 0, M 1, M 2, M – 2 – определенные функции температуры, которые вычислены и приведены в таблице, составленной М. И. Темкиным и Л. А. Шварцманом [14] и П2.
5.9. Индивидуальные задания по определению
констант равновесия и состава равновесных смесей
Для более глубокого освоения изучаемого материала студенту предлагается выполнение ряда заданий в соответствии с его индивидуальным вариантом. Первое задание посвящено определению константы равновесия данной реакции по приведенным энергиям Гиббса и методом Темкина-Шварцмана и сравнению с ее экспериментальным значением. Остальные четыре задания посвящены расчету состава равновесной смеси газовой и гетерогенной реакции, определению нормального сродства реагирующих веществ с использованием уравнения изотермы, изобары-изохоры и закона Кирхгофа.
Задание 1.
Вычислить константу равновесия Kр для данных реакций при заданных температурах двумя методами: по приведенным энергиям Гиббса и методом Темкина-Шварцмана и сравнить ее с табличным значением (табл. 5.3). Справочные данные взять из [П2].
Таблица 5.3
| № | Реакция | Т, К | lg Kр эксп |
| –2,856 | ||
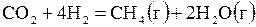
| 3,037 | ||
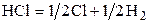
| –5,258 | ||
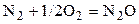
| –6,703 | ||
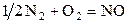
| –2,821 | ||
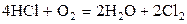
| 1,611 | ||

| 3,576 | ||
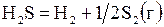
| –2,133 | ||
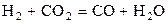 (г) (г)
| –0,607 | ||
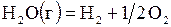
| –5,185 | ||
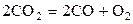
| –5,764 | ||
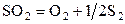
| –19,80 | ||
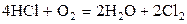
| –0,365 | ||
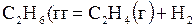
| –1,292 | ||
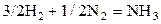
| –2,536 | ||
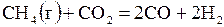
| –2,67 | ||
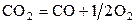
| –5,994 | ||
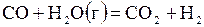
| –0,149 | ||
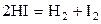
| –1,454 | ||
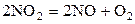
| 1,690 | ||
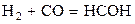
| –5,683 | ||
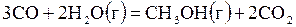
| 6,451 | ||
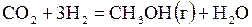
| –7,251 | ||
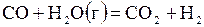
| 0,143 | ||
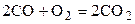
| 20,4608 |
Примечание. Экспериментальные значения lg Kр эксп даны для случая, когда парциальные давления выражены в атмосферах.
Задание 2.
На основании табличных данных [П2] определить:
1) нормальное (стандартное) сродство вещества А к В (изменение термодинамического потенциала) при Т, К для данной реакции;
2) выход газа D при общем давлении 1,0133×105 Па и Т, К, если газообразные вещества А и В введены в реакционный сосуд в стехиометрических количествах;
3) изменение изобарно-изотермического потенциала для начального момента реакции, если исходные давления газов реакционной смеси равны Р А, Р В, Р C, Р D и реакция происходит при Т, К (табл. 5.4).
Таблица 5.4
| № | Реакция | A | B | C | D | Р ×10-4, Па | T, K | |||
| A | B | C | D | |||||||

| H2 | O2 | – | H2O | – | |||||

| H2 | O2 | – | H2O | – | |||||
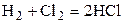
| H2 | Cl2 | – | HCl | – | 1,5 | ||||
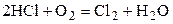
| HCl | O2 | Cl2 | H2O | 1,5 | 1,5 | ||||
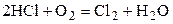
| HCl | O2 | Cl2 | H2O | ||||||
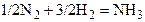
| N2 | H2 | – | NH3 | – | |||||
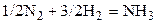
| N2 | H2 | – | NH3 | – | |||||
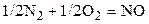
| N2 | O2 | – | NO | – | 0,3 | ||||

| N2 | O2 | – | NO | – | |||||
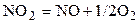
| NO2 | – | NO | O2 | – | |||||
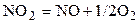
| NO2 | – | NO | O2 | – | |||||
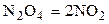
| N2O4 | – | – | NO2 | – | – | ||||
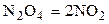
| N2O4 | – | – | NO2 | – | – | ||||
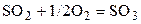
| SO2 | O2 | – | SO3 | – | 1,5 | ||||

| SO2 | NO2 | SO3 | NO | 1,5 | 1,2 | ||||
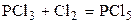
| PCl3 | Cl2 | – | PCl5 | – | |||||
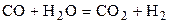
| CO | H2 | CO2 | H2 | 0,7 | 1,6 | ||||
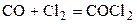
| CO | Cl2 | – | COCl2 | – | 0,5 | ||||
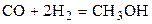
| CO | H2 | – | CH3OH | – | 1,6 | ||||
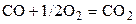
| CO | O2 | – | CO2 | – | |||||
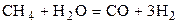
| CH4 | H2O | CO | H2 | 0,8 | 0,7 | ||||
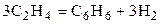
| C2H4 | – | C6H6 | H2 | - | 0,7 | ||||
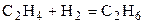
| C2H4 | H2 | – | C2H6 | – | |||||
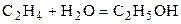
| C2H4 | H2O | – | C2H5OH | – | 1,2 | ||||
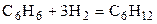
| C6H6 | H2 | – | C6H12 | – |
Задание 3.
Газообразные вещества А и В реагируют по заданному уравнению реакции с образованием газообразного вещества С.
1. Выразить Kр и Kс через равновесное количество вещества С, равное x, если исходные вещества А и В взяты в стехиометрических количествах при общем давлении в системе Р и температуре Т, К.
2. Рассчитать величины Kр и Kс при 300 К, если Р = 7,5×104 Па, а х = 0,45.
3. Вычислить равновесное количество вещества С при Р = 3×104 Па и температуре 300 К.
4. Рассчитать степень превращения вещества А и В при 300 К
(табл. 5.5).
Таблица 5.5
| № | Реакция | № | Реакция |
А+В= 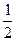 C C
| 3A+ 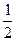 B=2C B=2C
| ||
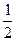 A+B=C A+B=C
| 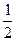 A+ A+ 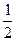 B=2C B=2C
| ||
| 2A+B=2C | 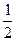 A+ A+ 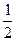 B=3C B=3C
| ||
| 2A+3B=3C | A+3B=3C | ||
2A+ 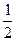 B=2C B=2C
| 3A+B=C | ||
3A+ 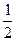 B=C B=C
| A+2B=2C | ||
| A+2B=C | A+2B=3C | ||
| A+B=3C | A+B=2C | ||
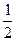 A+B=2C A+B=2C
| 2A+2B=C | ||
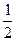 A+B=3C A+B=3C
| 2A+2B=3C | ||
2A+ 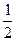 B=3C B=3C
| 3A+3B=2C | ||
| 2A+3B=2C | 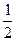 A+B= A+B= 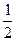 C C
| ||
3A+ 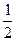 B=3C B=3C
| 
|
Задание 4.
Гетерогенная реакция протекает при постоянной температуре Т.
1. Определить нормальное сродство вещества А и В при Т 0 = 298 К;
2. вычислить константы Kр и Kс равновесия реакции;
3. определить количество прореагировавшего твердого вещества А, если объем системы равен V м3, а исходное давление газа В равно Р 1 (объемом твердой фазы можно пренебречь);
4. определить изменение изобарно-изотермического потенциала, отнесенное к началу реакции, если исходные давления газообразных веществ В и С соответственно равны Р 2 и Р 3 (табл. 5.6).
Таблица 5.6
| № | Реакция А+В=С | Т, К | Р 1×10-2, Па | Р 2×10-2, Па | Р 3×10-2, Па | V ×103, м3 |
| C+2H2 = CH4 | ||||||
| C+2H2 = CH4 | ||||||
| C+2H2 = CH4 | ||||||
| C+2H2 = CH4 | ||||||
| 2C+2H2 = C2H4 | ||||||
| 2C+2H2 = C2H4 | ||||||
| 2C+2H2 = C2H4 | ||||||
| 2C+O2 = 2CO | ||||||
| 2C+O2 = 2CO | ||||||
| 2C+O2 = 2CO |
Задание 5.
Зависимость константы равновесия реакции от температуры выражается уравнением типа
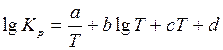
(коэффициенты а, b, c, d приведены в табл. 5.7).
1. Определить константу равновесия при Т, К.
2. Построить график зависимости в координатах 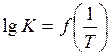 в пределах температуры от (Т – 100) до (Т + 100), К.
в пределах температуры от (Т – 100) до (Т + 100), К.
3. Указать, как изменяется константа равновесия с изменением температуры.
4. Определить графически тепловой эффект реакции 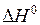 при температуре Т, К.
при температуре Т, К.
5. Полученную величину теплового эффекта сопоставить с величиной теплового эффекта, вычисленной по закону Кирхгофа при температуре Т, К.
6. Определить стандартное сродство реагирующих веществ 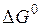 , а также
, а также 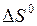 при температуре Т, К (табл. 5.7).
при температуре Т, К (табл. 5.7).
Справочные данные взять из [П2].
Таблица 5.7
| № | Реакция | Т, К | a | b | c | d |
| 2H2+CO = CH3OH | –9,1298 | 0,00308 | 3,401 | |||
| 4HCl+O2 = 2H2O+2Cl2 | –2,136 | –0,000857 | – 4,710 | |||
| 2N2+6H2O = 4NH3+3O2 | –66250 | –1,75 | –10,206 | |||
| 2N2+6H2O = 4NH3+5O2 | – 47500 | –1,75 | –13,706 | |||
| 2NO2 = 2NO+O2 | –5749 | 1,75 | –0,0005 | 7,899 | ||
| N2O4 = 2NO2 | –2692 | 1,75 | –0,00483 | 1,944 | ||
| Mg(OH)2(T) = MgO(T) + H2O(Г) | – 4600 | 0,623 | –0,00102 | 17,776 | ||
| CaCO3(T) = CaO(T) + CO2(Г) | –9680 | –1,385 | –0,000216 | 17,756 | ||
| Са(OH)2(T) = СаO(T) + H2O(Г) | –5650 | –0,67 | 0,000414 | 9,616 | ||
| S2+4H2O = 2SO2+4H2 | –13810 | –0,877 | 0,00267 | 8,386 | ||
| S2+4CO2 = 2SO2+4CO | –23000 | 4,34 | –0,00162 | 2,576 | ||
| 2SO2+O2 = 2SO3 | 1,222 | –18,806 | ||||
| SO2+Cl2 = SO2Cl2 | –1,75 | 0,000455 | –7,206 | |||
| CO+3H2 = CH4+H2O | –7,14 | 0,00188 | –1,371 | |||
| 4CO+2SO2 = S2+4CO2 | –6,34 | 0,0000002 | –2,576 | |||
| COCl2 = CO+Cl2 | 1,75 | 3,748 | ||||
| CO2+H2 = CO+H2O | –2203 | –0,0000516 | 2,3 | |||
| CO2+4H2 = CH4+2H2O | –6,23 | 0,000906 | –1,291 | |||
| 2CO2 = 2CO+O2 | –29500 | 1,75 | –0,001215 | 3,29 | ||
| 2CO+2H2 = CH4+CO2 | 3,113 | –0,0028524 | –1,483 | |||
| C2H6 = C2H4+H2 | –6365 | 2,961 | –0,000766 | –2,344 | ||
| C2H5OH = C2H4+H2O | –1485 | 7,54 | –0,00425 | 7,006 | ||
| CH3CHO+H2 = C2H5OH | 5,42 | –0,00229 | –2,810 | |||
| C6H6+3H2 = C6H12 | –9,9194 | 0,002285 | –6,452 |
5.10. Примеры выполнения заданий
Пример 1. Если нагреть 0,746 кг йода и 0,0162 кг водорода в закрытом сосуде емкостью 1 м3 до 693 К, то при достижении равновесия образуется 0,721 кг йодистого водорода. Сколько йодистого водорода получится, если к исходной смеси добавить 0,1 кг йода и 0,005 кг водорода?
Дано:
m 1 = 0,746 кг
µ1 = 254·10-3 кг/моль
m 2 = 0,0162 кг
µ2 = 2·10-3 кг/моль
V = 1 м3
T = 693 К
m 3= 0,721 кг
µ3 = 128·10-3 кг/моль
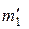 = 0,1 кг = 0,1 кг
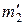 = 0,005 кг = 0,005 кг
|
Найти:
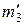 –? –?
|
Решение. Рассматриваемая в задаче реакция протекает по уравнению:
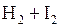
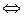
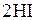 .
.
Константа равновесия этой реакции, выраженная через концентрации, может быть записана в виде:
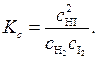 (5.43)
(5.43)
Учитывая, что равновесная концентрация 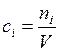 , где
, где 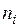 – число молей
– число молей 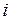 -го вещества в равновесной смеси, перепишем выражение (5.43):
-го вещества в равновесной смеси, перепишем выражение (5.43):
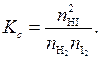 (5.44)
(5.44)
Число молей 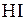 в равновесной смеси найдем из уравнения:
в равновесной смеси найдем из уравнения:
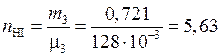 (моль).
(моль).
Найдем число молей  и
и  перед началом реакции:
перед началом реакции:
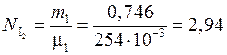 (моль);
(моль);
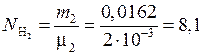 (моль).
(моль).
Реакция протекает при постоянном объеме, поэтому согласно уравнению реакции из 1 моль йода и 1 моль водорода образуется 2 моль йодистого водорода, поэтому на образование  моль йодистого водорода пойдет 2,82 моль йода и 2,82 моль водорода. Следовательно, в равновесной смеси останется:
моль йодистого водорода пойдет 2,82 моль йода и 2,82 моль водорода. Следовательно, в равновесной смеси останется:
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 3328; Нарушение авторских прав?; Мы поможем в написании вашей работы!