
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория скользящих нитей
|
|
|
|
Способ сокращения волокон скелетной мышцы был определен в результате двух различных исследований, проведенных в начале 1950-х годов при участии ученых Эндрю и Хью Хаксли. В то время, когда Хью Хаксли проводил свои исследования при помощи электронного микроскопа, Эндрю Хаксли использовал интерференционный микроскоп для изучения характеристик мышечных волокон лягушки во время сокращения и расслабления. Он обнаружил, что во время сокращения светлый диск становился короче, тогда как длина темного диска не изменялась; в то же время бледная Н-зона в темном диске сужалась и могла вообще исчезнуть. Оба ученых независимо друг от друга выдвинули предположение, что полученные ими результаты можно объяснить скользящим движением филаментов актина и миозина относительно друг друга. Теория скольжения филаментов сегодня является общепризнанной. Кратко ее сущность состоит в следующем.
Установлено, что во время сокращения (укорочения) саркомера длина тонкого и толстого филаментов не меняется. При этом неизменной особенностью сокращения является центральное положение толстого филамента в саркомере, посередине между Z-дисками. При поступлении по аксону мотонейрона нервного импульса нервные окончания выделяют нейромедиатор – ацетилхолин, который «привязывается» к рецепторам сарколеммы. При достаточном его количестве электрический заряд передается по всей длине волокна. Этот процесс называется развитием потенциала действия. Кроме деполяризации мембраны мышечного волокна, электрический импульс проходит через сеть трубочек волокна (Т-трубочки и саркоплазматический ретикулум) во внутреннюю часть клетки. Поступление электрического импульса приводит к выделению значительного количества ионов Са2+ в саркоплазму. Следует заметить, что концентрация ионов Са2+ в саркоплазматическом ретикулуме выше, чем в саркоплазме. После этого ионы Са2+ связываются с тропонином, который начинает процесс сокращения, «поднимая» молекулы тропомиозина с активных участков актиновых филаментов.
Миозин в покое неактивен, так как на его головке находится отрицательно заряженный комплекс Mg, ATФ, не позволяющий белку проявлять АТФ-азные свойства. После поступления ионов Са2+ происходит нейтрализация заряда на головке, что приводит миозин в возбужденное состояние. После этого миозиновые головки начинают прикрепляться к активным участкам актинового филамента.
Когда миозиновая головка толстого филамента прикрепляется к тонкому филаменту, между толстым и тонким филаментами образуется поперечный мостик. При взаимодействии с актином каждая миозиновая молекула ежесекундно гидролизует до 10 молекул АТФ. За счет энергии, высвобождающейся при расщеплении АТФ, миозиновая головка поворачивается, что приводит к скольжению толстого и тонкого филаментов относительно друг друга. В конце гребка (поворота) к миозиновой головке присоединяется новая молекула АТФ, что приводит к отделению головки от актина и присоединению к новому активному участку тонкого филамента до тех пор, пока миозиновые головки не достигнут Z-диска. Так как при сокращении саркомера расстояние между Z-дисками уменьшается, происходит уменьшение его длины. Одновременное сокращение всех саркомеров приводит к уменьшению длины миофибриллы и мышечного волокна. Ввиду того, что саркомер представляет собой не плоскую, а объемную структуру, при его сокращении происходит не только уменьшение его длины, но и увеличение его поперечного сечения (когда тонкие нити втягиваются в толстые), поперечного сечения мышечных волокон и всей мышцы. рис.1.5.
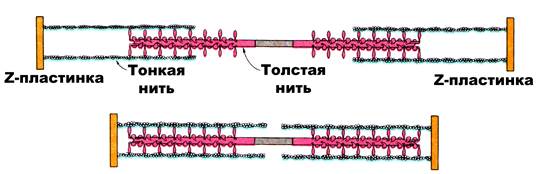
Рис. 1.5. Схема, иллюстрирующая взаимодействие толстого и тонкого филаментов (Л. Страйер, 1985)
Прекращение нервного импульса приводит к расщеплению ацетилхолина и разрыву поперечных мостиков между актином и миозином. Благодаря действию «кальциевого насоса» ионы Са2+ возвращаются в саркоплазматический ретикулум, актин и миозин инактивируются, длина саркомера возвращается к исходному значению. Мышца расслабляется. Мышечное сокращение может продолжаться до тех пор, пока не истощатся запасы ионов кальция. Затем они снова перекачиваются в саркоплазматический ретикулум посредством активной системы «кальциевого насоса». Следует отметить, что для осуществления этого процесса необходима энергия АТФ.
Каким образом доставляется энергия к филаментам? Кроме участка для прикрепления к тонкому филаменту, миозиновая головка содержит участок, в котором локализуется АТФ. Освобождающая вследствие реакции гидролиза (расщепления АТФ) энергия используется для прикрепления миозиновой головки к тонкому филаменту, а после осуществления поворота головки – для отделения миозиновой головки от тонкого филамента.
1.6. Типы скелетных мышечных волокон и их морфофункциональная характеристика
Рассматривая макроструктуру скелетных мышц, были выделены три основных элемента: это фасции, мышечные волокна и сухожилия. В этом параграфе мы более подробно рассмотрим типы мышечных волокон, так как от этого во многом зависит способность мышц к проявлению силы, скорости, а также выносливости.
Вначале были выделены два типа скелетных мышечных волокон, каждый из которых имел свои физиологические особенности. Это – медленные (тонические) и быстрые (фазические) волокна. В некоторых мышцах могут быть только быстрые или только медленные волокна, в других – волокна обоих типов в определенном соотношении. В дальнейшем были выделены мышечные волокна промежуточного типа.
Благодаря различным типам волокон организм способен передвигаться и поддерживать позу. Быстрые волокна позволяют мышце сокращаться с высокой скоростью. В большом количестве эти волокна имеются у хищников; они обеспечивают быстроту реакции при ловле добычи. С другой стороны, потенциальная добыча, чтобы не стать жертвой хищников, тоже должна быть способна к быстрому реагированию. В обоих случаях от подвижности животного будут зависеть его шансы на выживание. Когда животное находится в покое, оно поддерживает определенную позу с помощью тонических мышечных волокон. Им свойственно более медленное и длительное сокращение и в то же время энергетические затраты меньше, чем при сокращении быстрых волокон. Сокращение их по своей природе обычно изометрическое, при котором мышцы, противодействуя силе тяжести и удерживая конечности в определенном положении, сохраняют постоянную длину.
У человека все мышцы тела состоят из волокон трех типов, но обычно один из них доминирует. Это имеет физиологическое значение, поскольку тонические мышцы способны к медленному и длительному сокращению и поэтому медленных волокон больше в позных мышцах-разгибателях, тогда как в сгибателях, предназначенных для быстрых реакций, преобладают быстрые фазические волокна.
Согласно современным представлениям, большинство скелетных мышц человека и животных представляют собой гетерогенные морфофункциональные системы, состоящие из мышечных волокон, отличающихся по структуре, метаболизму и функции.
Мышечные волокна I типа в мировой номенклатуре обозначают как красные, окислительные, медленные, устойчивые к утомлению. В мышечных волокнах I типа хорошо выражен Z-диск, который толще, чем в мышечных волокнах других типов, саркоплазмаческий ретикулум развит в меньшей степени, чем в других типах мышечных волокон. В данных структурах выявляется много митохондрий с поперечной ориентацией. В саркоплазме обнаруживаются липидные капли, которые часто контактируют с митохондриями. Мышечные волокна I типа характеризуются также высокой степенью кровообращения. Каждое мышечное волокно I типа контактирует с 5-6 кровеносными капиллярами. В этих волокнах отмечается самое высокое содержание миоглобина. Согласно данным гистохимических исследований, в волокнах I типа обнаруживается более низкая активность креатинфосфокиназы, чем в других мышечных волокнах.
Мышечные волокна IIВ типа в мировой номенклатуре обозначают как белые, быстрые, гликолитические, быстроутомляемые. Z-диск в мышечных волокнах IIВ типа более тонкий, чем в волокнах других типов. В данных структурах очень хорошо развит саркоплазматический ретикулум, системы терминальных цистерн и триад. В саркоплазме мышечных волокон IIB типа сравнительно немного малых по размерам митохондрий, содержащих небольшое число крист. Мышечные волокна IIВ типа контактируют с меньшим количеством капилляров, чем мышечные волокна других типов. Кроме того, в этих волокнах имеется очень мало миоглобина. Именно этим объясняется их более светлая окраска, благодаря чему они и получили название «белых». В мышечных волокнах IIB типа содержание креатинфосфата выше, чем в других типах мышечных волокон.
Мышечные волокна IIA типа в мировой номенклатуре обозначают как промежуточные, окислительно-гликолитические, быстрые, устойчивые к утомлению. Z-диск в мышечных волокна IIA типа, по мнению ряда авторов, толще, чем в мышечных волокнах IIВ типа и не отличается от такового в волокнах I типа. По данному показателю волокна типа IIA занимают промежуточное положение между мышечными волокнами I типа и мышечными волокнами IIB типа. В мышечных волокнах IIA типа хорошо развит саркоплазматический ретикулум и системы триад. Мышечные волокна IIА типа богаче митохондриями, чем волокна IIВ типа и практически не отличаются по этому признаку от мышечных волокон I типа. Митохондрии в мышечных волокнах I типа имеют преимущественно продольную ориентацию (по длине оси мышечных волокон). Они часто образуют скопления под сарколеммой. В саркоплазме мышечных волокон IIA типа встречается достаточно большое количество липидных капель. Мышечные волокна IIА типа содержат больше миоглобина, чем мышечные структуры IIВ типа. Содержание креатинфосфата в мышечных волокнах IIА типа ниже, чем в волокнах IIВ типа и не отличается от такового в волокнах I типа. Мышечные волокна данного типа представляются универсальными в плане их метаболизма. В связи с тем, что мышечные волокна IIА типа способны длительное время производить работу достаточно большой мощности, они должны рассматриваться как универсальные мышечные волокна в плане их функциональных возможностей.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1779; Нарушение авторских прав?; Мы поможем в написании вашей работы!