
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамическая вероятность данного макросостояния равна числу микросостояний, соответствующих этому макросостоянию
|
|
|
|
Термодинамическая вероятность, в противовес математической, всегда больше или равна единице, и равна числу благоприятных случаев, тогда как математическая равна отношению числу благоприятных к общему.
| № | Общее число случаев | Термодинамическая вероятность равномерного распределения | Математическая Вероятность равномерного распределения |
| 0,500 | |||
| 0,375 | |||
| 0,312 | |||
| 0,273 | |||
| 1 024 | 0,246 | ||
| 1 048 576 | 100 000 | 0,095 |
Со статистической точки зрения второй закон может быть сформулирован следующим образом.
Как правило, самопроизвольные процессы протекают от менее вероятных к более вероятным.
В принципе, однако, не исключены и обратные процессы.
Статистический характер энтропии позволяет толковать ее как меру неупорядоченности системы. Полный порядок в системе наблюдается, когда положение каждого объекта, составляющего систему, строго определено, следовательно, может быть только одно микросостояние, соответствующее макросостоянию системы (идеальный кристалл при температуре абсолютного нуля)
Наибольший беспорядок наблюдается у газообразных веществ. Для них термодинамическая вероятность и, следовательно, энтропия наибольшие. Порядок увеличивается при переходе к жидкости и еще больше — к кристаллу Это значит, что термодинамическая вероятность равна единице, а энтропия нулю. Это известный постулат Планка, или, как его иногда называют, третий закон термодинамики.
Исходными постулатами второго закона термодинамики могут служить следующие.
1. «теплота не может перейти сама собой от более холодного к более теплому телу»;
2. «невозможен процесс, единственным результатом которого было бы превращение теплоты в работу»;
3. «невозможно создать такую машину (т.н. вечный двигатель 2 – го рода), всё действие которой сводилось бы к производству работы за счет охлаждения теплового источника»
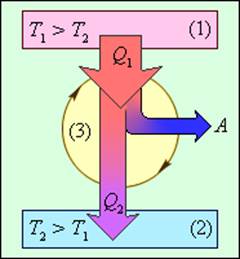
Рис. 1 Энергетическая схема тепловой машины;1 – источник тепла; 2 – приемник тепла; 3 – рабочее тело
Работа машины заключается не только в получении теплоты от источника тепла Q1 и совершении работы, но и одновременной передаче части теплоты Q2 теплоприемнику с более низкой температурой.

Схема компрессионного теплового насоса 1) конденсатор, 2) дроссель, 3) испаритель, 4) компрессор
Термодинамический коэффициент полезного действия
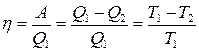
где отношение 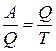 получило название приведенной теплоты процесса.
получило название приведенной теплоты процесса.
ЭНТРОПИЯ. НЕОБРАТИМЫЕ ПРОЦЕССЫ
В 1865 году в своей публикации Клаузиус показал, что существует такая термодинамическая функция, которая является функцией состояния системы и изменение которой для обратимого термодинамического процесса равно приведенной теплоте процесса

или для бесконечно малого изменения теплоты
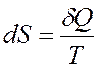
Эта функция получила название энтропия (от греч. entropia – поворот, превращение), которая определяет меру необратимого рассеяния энергии.
Разделив математическую формулировку первого закона термодинамики

на температуру будет иметь
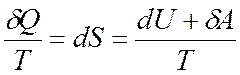
откуда
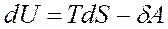
Вышеприведенное уравнение является аналитическим выражением первого и второго законов термодинамики для обратимых процессов, для которых
изменение энтропии равно тепловому эффекту процесса, отнесенному к абсолютной температуре системы.
Самопроизвольное течение процесса всегда связано с его необратимостью. Позволю напомнить читателю, что в термодинамическом смысле необратимость процесса определяется невозможностью возвращения системы в исходное состояние без того, чтобы в ней или в окружающей среде не осталось каких – либо изменений.
Необратимые процессы (например, процессы гидратации минералов портландцементного клинкера) сопровождаются увеличением энтропии системы; для них справедливым будет неравенство

Обобщая обратимые и необратимые процессы, можно отметить, что в этом случае

Из указанного выражения вытекают следующие соотношения
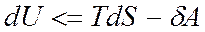
или

Знак равенства в приведенных выражениях определяет максимальную величину работы в обратимых процессах, в необратимых процессах работа всегда меньше.
Если рассматривать только работу против внешнего давления, то в изотермических процессах

С учетом этого

или
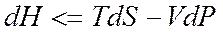
Для адиабатных процессов
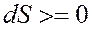
Из вышесказанного следует, что для изолированных систем, в которых совершаются обратимые процессы, энтропия системы постоянна, и она возрастает в случае необратимых процессов, окончание которых (достижение равновесного состояния) определяется выражением
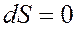
ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ
Внутреннюю энергию системы можно условно представить в виде суммы двух величин "свободной – Х " и "связанной – Y " энергии. Возможность рассчитать величину "свободной" энергии, т.е. той части внутренней энергии системы, которую можно превратить в работу, дает тепловая теорема Нернста, называемая также третьим началом (законом) термодинамики.
Основные положения тепловой теоремы заключаются в следующем:
1. При абсолютном нуле температуры свободная энергия X равна теплоте процесса.

2. При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.

Одной из формулировок третьего начала термодинамики является также постулат Планка:
Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
Строго говоря, тепловая теорема Нернста и постулат Планка являются следствиями из второго начала термодинамики; но независимо от этого они имеют очень большое значение, позволяя рассчитывать абсолютную энтропию системы и, следовательно, величину свободной энергии системы.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1364; Нарушение авторских прав?; Мы поможем в написании вашей работы!