
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
По учебной дисциплине 1 страница
|
|
|
|
ТЕЗАУРУС
По дисциплине «Теоретические основы
Таблица спецификации тестовых заданий
Структура содержания дисциплины.
Заданий
Комплект тестовых
По дисциплине «Теоретические основы теплотехники.
Термодинамика»
Авторы-разработчики ___________________ Каримов З.Ф.
___________________ Павлов Е.П.
Заведующий кафедрой___________________ Лебедев В.А.
Санкт – Петербург
«Теоретические основы теплотехники. Термодинамика»
1. Основные законы термодинамики.
1.1 Термодинамика идеального газа
1.2. Первый закон термодинамики
1.3. Второй закон термодинамики
2. Реальные газы. Водяной пар
2.1. Свойства и фазовые переходы реальных газов
2.2. Характеристики и процессы водяного пара
2.3. Влажный воздух
2.4. Термодинамика газового потока. Истечение газов через сопла
2.5. Расчет процессов дросселирования
3. Компрессоры. Циклы тепловых двигателей
3.1. Виды компрессоров и процессы в компрессоре
3.2. Циклы двигателей внутреннего сгорания (ДВС)
3.3. Циклы газотурбинных установок (ГТУ)
3.4. Циклы реактивных двигателей
4. Циклы паротурбинных установок (ПТУ)
4.1. Идеальный и действительный цикл ПТУ
4.2. Циклы ПТУ с промежуточным перегревом и регенеративным отбором пара
4.3. Циклы парогазовой и атомной установок
4.4. Циклы и устройства прямого преобразования теплоты в электрическую энергию
5. Циклы холодильных и теплонасосных установок
5.1. Циклы воздушной и парокомпрессорной холодильных установок
5.2. Передача теплоты тепловым насосом и тепловой трубой
6. Элементы химической термодинамики
6.1. Законы термодинамики в термохимии
6.2. Уравнения максимальной работы химической реакции
теплотехники. Термодинамика»
| Номер темы (раздел) | Уровень сложности | ||
| 1. Основные законы термодинамики | 1-6, 18-20 | 7-17, 21-23, 25-28 | 24, 32-34, 41, 43 |
| 29-31, 40, 42 | 35-39 | ||
| 2. Реальные газа Водяной пар | 44-47, 51, 60-64 | 54, 55, 58, 65-74 | 48,50, 52, 53 |
| 56, 57, 59, 75-76 | |||
| 3. Компрессоры Циклы тепловых двигателей | 81-83, 88-91, 97-99 | 84-87, 93, 94, 100 | 77-80, 95, 96 |
| 104-106 | 101-103 | ||
| 4.Циклы паротурбинных установок | 115, 116, 119-124 | 112-114, 117-118 | 107-111 |
| 125, 126 | |||
| 5. Циклы холодильных и теплонасосных установок | 127_130, 132, 133 | 134-136, 139 | 131, 140, 143, 144 |
| 137, 138, 141, 142 | 145-147 | ||
| 6.Элементы химической термодинамики | 148-151 | 155-157 | 158-160 |
«Теоретические основы теплотехники. Термодинамика»
| Номер темы | Понятие, утверждение | Определение |
| Термодинамические параметры состояния Термодинамический процесс Уравнение состояния | численные значения величин, характеризующие состояние рабочего тела (термодинамической системы тел) совокупность последовательных состояний, через которое проходит рабочее тело при взаимодействии с окружающей средой. устанавливает функциональную зависимость параметров состояния рабочего тела (идеального или реального газа) в виде f(P, V, T)= 0. | |
| Дросселирование Пар Влажный воздух Изопараметрический процесс | необратимый процесс протекания газа через местное сопротивление (суженное сечение), в результате которого уменьшается давление газа без совершения технической работы. реальный газ близкий к состоянию насыщения, т.е. к превращению в жидкость. смесь сухого воздуха с водяным паром. процесс, протекающий при постоянном значении одного из параметров состояния (Р, Т, V = const). | |
| Цикл Карно Цикл | цикл состоящий из двух изотермических и двух адиабатных процессов. совокупность последовательных процессов, в результате которых термодинамическая система, выведенная из некоторого состояния возвращается в исходное состояние и совершается работа. | |
| Цикл термодинамический (идеальный) | совокупность термодинамических процессов, в котором теплоемкость, химический состав и объем рабочего тела не меняются, процессы сжатия и расширения адиабаты, процессы сгорания и газообмена заменяются на условные процессы подвода и отвода теплоты. | |
| Холодильные машины Холодопроизводительность | машины предназначенные для понижения температуры охлаждаемого тела ниже температуры окружающей среды и непрерывного поддерживания заданной низкой температуры в течение определенного времени. количество теплоты, отводимой в единицу времени от охлаждаемого тела (объекта). | |
| Стехиометрическое уравнение Скорость химической реакции | уравнение химической реакции, выражающее эквивалентные соотношения между компонентами. количество вещества в молекулах, прореагировавшее в единице объема за единицу времени. |
Комплект тестовых заданий по дисциплине «Теоретические основы теплотехники. Термодинамика»
К разделу 1
1. Единица давления -1 атмосфера равна:
а. Примерно 0,1 МПа.
b. 1 Па.
c. 1 МПа.
d. 760 мм рт.ст.
2. Закону Бойля - Мариотта соответствует соотношение:
а. p1 / p2 = v2 / v1.
b. p1 / p2 = T1 / T 2.
c. p1 / p2 = v1 / v2.
d. v1 / v2 = T1 / T2.
3. Закону Гей- Люссака соответствует соотношение:
а. p1 / p2 = v2 / v1.
b. p1 / p2 = T1 / T 2.
c. v1 / v2 = T1 / T2.
d. p1 / p2 = v1 / v2.
4. Закону Шарля соответствует соотношение:
а. p1 / p2 = v2 / v1.
b. p1 / p2 = v1 / v2.
c. p1 / p2 = T1 / T 2.
d. v1 / v2 = T1 / T2.
5. Закону Авогадро означает, что:
а. Моли различных идеальных газов при одинаковых давлениях и температурах занимают одинаковый объем.
b. Моли различных идеальных газов при одинаковых давлениях занимают одинаковый объем.
c. Моли различных идеальных газов при одинаковых мольных массах занимают одинаковый объем.
d. Моли различных идеальных газов при нормальных физических условиях занимают объем, равный 22.4 м3.
6. Связь газовой постоянной R с теплоемкостями cр и cv выражается зависимостью:
а. c p- c v
b. cp
c. c p + cv
d. cp / cv
7. Теплоемкость представляет собой отношение подведенного:
а. к телу количества теплоты к достигнутой разности температур тела.
b. к телу количества теплоты к величине изменения внутренней энергии тела.
c. к телу количества теплоты к величине изменения давления тела.
d. к телу количества теплоты к величине изменения энтальпии тела.
8. Смесь идеальных газов представляет собой:
а. материю, состоящую из химически инертных идеальных газов.
b. субстанцию, составляющую сумму одинаковых количеств молей различных сред.
c. субстанцию, содержащую различные легкие газы.
d. материю, состоящую из химически взаимодействующих
легких газов.
9. Смесь идеальных газов может быть задана при помощи:
а. массовых и объемных долей.
b. парциальных давлений компонентов.
c. парциальных (приведенных) объемов.
d. в виде суммы мольных масс компонентов.
10. Показатель политропы при изотермическом процессе равен:
а. n=1.
b. n=0.
c. n=oo.
d. n=k.
11. Показатель политропы при адиабатном процессе равен:
a. n=k.
b. n=0.
c.n=oo.
d. n=1.
12. Показатель политропы при изобарном процессе равен:
а. n=0.
b. n=1.
c.n=oo.
d.n=k.
13. Показатель политропы при изохорном процессе равен:
a. n=oo.
b. n=0.
c.n=1.
d.n=k.
14. Теплоемкость идеального газа при изотермическом процессе равна:
а. с=oo.
b. с=0.
c. с=1.
d. с=k.
15. Теплоемкость идеального газа при изобарном процессе равна:
а. с=cp.
b. с=0.
c. с=cp.
d. с=k.
16.. Теплоемкость идеального газа при изохорном процессе равна:
а. с= cv.
b. с=0.
c. с= cp.
d. с=k.
17. Теплоемкость идеального газа при адиабатном процессе равна:
а. с=0.
b. с= cp.
c. с= cv.
d. с=oo.
18. Площадь под кривой процесса на pv -диаграмме равна:
а. механической работе процесса.
b. внутренней энергии рабочего тела.
c. энтальпии рабочего тела.
d. теплоемкости рабочего тела.
19. Площадь под кривой процесса на Ts -диаграмме равна:
а. теплоте процесса.
b. энтальпии рабочего тела.
c. энтропии рабочего тела.
d. теплоемкости рабочего тела.
20. Элементарная работа расширения газа dl определяется выражением:
а. p * dv.
b. сp * dt.
c. cv * dt.
d. T * d s.
21. Теплоемкость политропного процесса меняется в пределах:
а.  .
.
b. 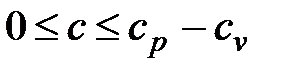
c. cv < c < cp.
d. Rг < c < 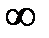 .
.
22. Теплоемкость газа при повышении температуры:
а. Увеличивается.
b. Уменьшается.
c. Остается неизменной.
d. Колеблется около некоторого среднего значения.
 23. Л иния 1-b на Ts –диаграмме соответствует процессу:
23. Л иния 1-b на Ts –диаграмме соответствует процессу:
а. Адиабатному.
b. Изотермическому.
c. Политропному при n < k.
d. Политропному при n > k.
24. Масса идеального газа при неизменных температуре и плотности увеличивается вдвое. При этом давление газа:
а. Увеличится в 2 раза.
b. Уменьшится в 2 раза.
c. Уменьшится в 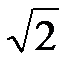 раза.
раза.
d. Не изменится.
25. Внутренняя энергия идеального газа:
а. Зависит от температуры, не зависит от объема.
b. Зависит от объема и температуры.
c. Не зависит от давления и температуры.
d. Не зависит от объема и температуры.
26. Можно судить о том, подводится теплота к рабочему телу или отводится от него по изменению величины:
а. Энтропия.
b. Удельный объем.
c. Энтальпия.
d. Температура.
27. Термодинамическая система называется изолированной, если:
а. Система не обменивается с окружающей средой любыми видами энергии.
b. Система не обменивается с окружающей средой теплотой и механической работой.
c. Система не обменивается с окружающей средой механической работой.
d. Система не обменивается с окружающей средой химической энергией и теплотой.
28. Знак работы можно определить по изменению величины:
а. Удельный объем.
b. Температура.
c. Энтропия.
d. Внутренняя энергия.
29. Содержание второго начала термодинамики соответствует соотношению:
а.d s  d q /T.
d q /T.
b. d s 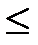 d q /T.
d q /T.
c. d s < d q /T.
d. d s = d q /T.
30. Абсолютное давление соответствует (B 0 - барометрическое давление; p изб — избыточное давление; Н 0 — разрежение.) соотношению:
а. В 0 + p изб.
b. В 0 – p изб.
c. Н 0 + p изб.
d. p изб – В0 .
31. Изменение энтальпии равно теплоте процесса:
а. Изобарный.
b. Изотермический.
c. Адиабатный.
d. Изохорный.
32. В изотермическом процессе при увеличении массы и плотности идеального газа в два раза давление:
а. Увеличится в 2 раза.
b. Уменьшится в  раза.
раза.
c. Уменьшится в 2 раза.
d. Не изменится.
33. В закрытом сосуде находится идеальный газ при избыточном давлении р 1 = 0,02 МПа и температуре t1 = 400 ºС. Барометрическое давление 0,1 МПа. Происходит охлаждение газа, разрежение в сосуде достигает р 2 = 0,03 МПа., при этом температура газа должна равняться:
а. 168.
b. 233.
c. 120.
d. 267.
34. Воздух с начальными температурой t1 =40°С, и объемом V1 =0,1 м3 содержится в цилиндре (диаметром цилиндра D=0,4 м) с подвижным поршнем. При нагреве воздуха до t2 =1200 C перемещение поршня (м) равно:
а. 0,21.
b. 1,59.
c. 0,11.
d. 0,85.
35. Теплоемкость идеального газа бесконечно велика в процессе:
а. Изотермический процесс.
b. Политропный процесс, n > k.
c. Адиабатный процесс.
d. Политропный процесс, n < k.
36. К идеальному газу в политропном процессе с показателем n == 2,2 подводится теплота. Этот процесс происходит при соблюдении следующих неравенств (l - работа процесса; ∆ u -изменение внутренней энергии):
а. l < 0; ∆ u > 0.
b. l > 0; ∆ u < 0
c. l > 0; ∆ u > 0
d. l < 0; ∆ u < 0.
37. Идеальный газ расширяется по политропе с показателем n ==0,7. При этом теплота процесса q и изменение внутренней энергии ∆ u соответствуюткомбинации неравенств:
a. q > 0; ∆ u >0.
b. q < 0; ∆ u < 0.
c. q > 0; ∆ u <0.
d. q < 0; ∆ u > 0.
38. С ростом температуры показатель адиабаты идеального газа k= сp / сυ
(теплоемкости сp и сυ зависят от температуры):
a. Возрастает.
b. Не изменяется.
c. Убывает.
d. Однозначный ответ невозможен.
39. Для идеального газа справедливо неравенство:
а. сp > с υ >0.
b. с υ < 0 < сp.
c. сp < с υ < 0.
d. 0 < сp < с υ.
40. Связь между парциальными давлениями компонентов смеси идеальных газов и ее общим давлением устанавливается законом
а. Дальтона.
b. Авогадро.
c. Шарля.
d. Лей-Люссака.
41. Газовая постоянная смеси водорода Н2 и азота N2 равна Rсм = 900 Дж/(кг •К), массовая доля водорода в смеси:
а. 0,156.
b. 0,844.
c. 0,233.
d. 0,767.
42. Внутренняя энергия идеального газа:
а. Зависит от объема и температуры.
b. Зависит от давления, не зависит от объема.
c. Не зависит от давления и температуры.
d. Не зависит от давления и объема.
43. Разность с с — с υ изобарной и изохорной теплоемкостей для вещества, которое подчиняется уравнению состояния р (υ — b) = RТ (b = соnst) равна:
а. R.
b. pu/Т.
c. pb/Т.
d. bR/υ.
К разделу 2
44. Эксергия представляет собой:
а. меру энергетических ресурсов, определяющую работоспособность вещества или энергии.
b. сумму химической и механической энергий вещества.
c. среднюю теплоемкость газовой смеси.
d. метод сравнения между собой любых видов энергии.
45. Подвод теплоты к рабочему телу или отвод от него можно определить по изменению величины:
а. Энтропия.
b. Энтальпия.
c. Температура.
d. Удельный объем.
46. Знак работы можно определить по изменению величины:
а. Удельный объем.
b. Внутренняя энергия.
c. Энтропия.
d. Температура.
47. Приращение внутренней энергии идеального газа du определяется выражением:
а. cv * dt.
b. p * dv.
c. cp * dt.
d. T * ds.
48. Идеальный газ, занимающий объем 0,05 м3, при давлении p1= 0,1 МПа сжимается изотермически до половины объема. При этом количество теплоты (кДж), участвующее в процессе, будет равно:
а. -3,47.
b. 3,47.
c. -34,7.
d. -1,73.
49. Полным дифференциалом для d z является выражение:
а. d z = T d s – p d υ.
b. d z = T d s.
c. d z = cυ d T – p d υ.
d. d z = — p d υ
50. Условие механического равновесия системы с окружающей средой соблюдается, если между внешним давлением p внеш и внутренним давлением р внут соответствует выражению:
а. | p внеш - р внут|/ p внут <<1.
b. | p внеш - р внут|/ p внут  1.
1.
c. | p внеш - р внут|/ p внут >1.
d. | p внеш - р внут|/ p внут  1.
1.
51. Наиболее полное определение понятия «идеальный газ» соответствует состояние:
а. реального вещества, в котором можно пренебречь размерами молекул и силами взаимодействия между ними.
b. реального вещества, в котором можно пренебречь силами взаимодействия между молекулами.
c. реального вещества, в котором не существенно влияние вращательного, колебательного и поступательного движения молекул.
d. реального вещества, в котором можно пренебречь размерами молекул.
52. Значение производной ( Т /
Т /  s) р (с2 • К2/м2) для идеального газа, при (
s) р (с2 • К2/м2) для идеального газа, при ( Т /
Т /  s) υ = 0,5 с2 • К2/м2 и µ cр = 28 кДж/(кмоль • К) равно:
s) υ = 0,5 с2 • К2/м2 и µ cр = 28 кДж/(кмоль • К) равно:
a. 0,211.
b. 0,352.
c. 0,711.
d. 0,5.
53. Расстояние по горизонтали ∆ s между изохорами υ 1= const
и υ 2 = const в Тs -диаграмме идеального газа равно:
a. ∆ s = R ln (υ2 / υ 1).
b. ∆ s = cυm ln (υ1 / υ 2).
c. ∆ s = cυm ln (υ2 / υ 1).
d. ∆ s = cpm ln (υ1 / υ 2).
54. Нагревается или охлаждается идеальный газ в процессе расширения по закону υ ~ р —0,5? Положительна или отрицательна теплоемкость с в этом процессе?
a. Нагревается, с > 0.
b. Охлаждается, с < 0.
c. Нагревается, с < 0.
d. Охлаждается, с > 0.
55. Начальные и конечные температуры идеального газа в изобарном и адиабатном (изоэнтропном) процессах одинаковы. При этом абсолютная величина отношения работ в этих процессах | lp / ls | определяется неравенством:
а. | lp/ ls | = k – 1.
b. | lp/ ls | = k.
c. | lp/ ls | = 1/ k.
d. | lp/ ls | = 1/(k – 1).
56. Объемная доля кислорода в воздухе 21%., массовая доля
в нем азота равна:
а. 0.77
b. 79.
c. 81.
d. 76.
57. Из приведенных ниже соотношений (u - внутренняя энергия; f - свободная энергия) является правильным:
a. 
b. 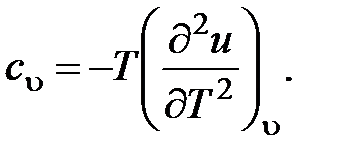
c. 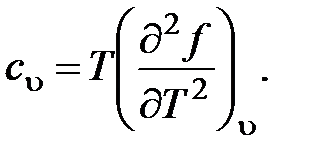
d. 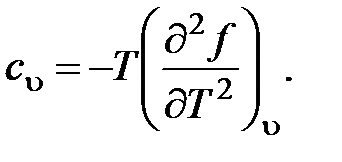
58. В связи с тем, что измерение энтропии непосредственно невозможно, для экспериментального определения зависимости энтропии от объема в изотермическом процессе необходимо измерять:
а. изменение объема с давлением в изотермическом процессе.
b. изменение давления с температурой в изохорном процессе.
c. изменение давления с температурой в адиабатном процессе.
d. изменение объема с температурой в изобарном процессе.
59. Из приведенных ниже частных производных между собой
(u -внутренняя энергия; h - энтальпия) равны:
a. 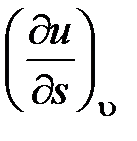 и
и  .
.
b.  и
и 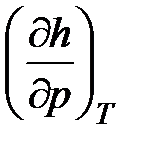 .
.
c.  и
и 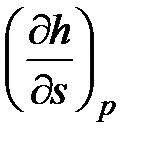 .
.
d.  и
и  .
.
60. Реальный газ представляет собой:
а. материю, микрочастиц которой обладают конечными массами, объемами и дистанционно взаимодействуют между собой.
b. субстанцию, состоящую из тяжелых фракций углеводородов.
c. материю, в которой имеет место трение между микрочастицами.
d. субстанцию, компоненты которой взаимно растворяются.
61. Параметры водяного пара можно определить:
а. по таблицам и диаграммам водяного пара.
b. по уравнению состояния Клапейрона-Менделеева.
c. по критическим параметрам.
d. по степени сухости.
62. Дросселирование газа (пара) это:
а. истечение газа через сопла.
b. понижение давления в гидравлических сопротивлениях.
c. понижение температуры газа.
d. перемешивание газа.
63. Относительная влажность воздуха  представляет отношение:
представляет отношение:
а. массы водяного пара в данном объеме влажного воздуха к его массе при насыщении.
b. масса водяного пара к массе сухого воздуха в данном объеме.
c. масса водяного пара к массе влажного воздуха в данном объеме.
d. массы насыщенного воздуха к массе насыщенного воздуха в данном объеме.
64. Степень сухости (х) водяного пара есть:
а. Отношение массы паровой фракции к общей массе влажного пара.
b. Отношение массы паровой фракции к массе жидкой фракции.
c. Отношение температуры пара к температуре насыщения.
d. Масса паровой фракции в единице объема.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 441; Нарушение авторских прав?; Мы поможем в написании вашей работы!