
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика и химическое равновесие
|
|
|
|
Между МОЛ
Сущность и содержание БУ
Главное правило БУ: «Нет записи без документа».
Объекты БУ: в пространстве
- имущество организации
-обязательства и их движение во времени
-и хозяйственные операции
движение = изменение = оборот
Задание:
Заполнить таблицу «Характерные черты бухгалтерского учета «на стр.1 в Рабочей тетради по бухгалтерскому учету.
.
План:
1) Понятие о скорости химической реакции.
2) Факторы, определяющие скорости гомогенных и гетерогенных реакций.
3) Химическое равновесие и способы его смещения.
Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой.
Скорость химической реакции – это количество исходного вещества, вступившего в реакцию, или количество продукта, полученного в единицу времени. В зависимости от реакционного пространства, где они протекают, химические реакции делятся на 2 типа:
1) гомогенные (протекающие в одной фазе, в растворах или газообразной среде);
2) гетерогенные (протекающие на поверхности раздела разных фаз).
Гомогенные реакции (Н2 (г) + Сl2 (г) = 2HCl (г)) протекают между газами или жидкостями в объеме (V). Если к моменту времени τ1 образовалось ν1 моль вещества, а к моменту τ2 – v 2 моль, то скорость гомогенной реакции определяется по формуле:
υ гом = v 2 - v 1/ (τ2 - τ1)∙ V = ∆С /∆ τ (моль/л ∙с),
где С - молярная концентрация образующегося вещества. Таким образом, скорость гомогенной реакции – это изменение концентрации вещества в единицу времени.
Гетерогенные реакции (например, горения углерода С(т) + О2 (г) = СО2 (г)) протекают на поверхности твердого вещества. Скорость такой реакции - это изменение количества вещества в 1 единицу времени на 1 единице поверхности твердого вещества:
υ гет = v 2 - v 1/ (τ2 - τ1)∙ S (моль/с∙ м2).
Механизмом реакции называется последовательность протекания всех ее промежуточных стадий. По механизму химические реакции делятся на простые, протекающие в одну стадию (например, диссоциация молекул водорода на атомы Н2 = 2Н) и сложные, протекающие в несколько стадий. Большинство химических реакций являются сложными. Скорость сложной реакции определяется скоростью самой медленной стадии, лимитирующей протекание всего процесса.
Скорость химических реакций зависит от следующих факторов:
1) природы реагирующих веществ. Это прежде всего прочность химической связи в их молекулах, каждая связь характеризуется определенным значением энергии, так Е N≡N в молекуле азота равна 942 кДж/моль, а Е О=О в молекуле кислорода 494 кДж/моль, поэтому реакция 2Н2 + О2 = 2Н2О протекает быстрее, чем 3Н2 + N2 = 2NН3. При сливании раствора H2SO4 c растворами BaCl2 и KNO3 протекают следующие химические реакции:
H2SO4 + BaCl2 = Ba SO4↓ + 2HCl,
(белый осадок)
H2SO4 + 2 KNO3 = K2SO4 + 2HNO3 (видимых изменений нет).
Здесь же можно указать на агрегатные состояния веществ, участвующих в реакции. Химические реакции между газами происходят очень быстро (часто со взрывом, примером может служить смесь метана с кислородом СН4 + 2О2 = СО2 + 2Н2О в объемном соотношении 1:2 (или 1:10 с воздухом), образующаяся в шахтах). Быстро смешиваются и жидкости. Для реакций с участием твердых веществ, протекающих на поверхности, размельчение увеличивает удельную поверхность и, следовательно, скорость реакции.
Условием взаимодействия веществ, участвующих в химической реакции, является контакт (столкновение) их частиц. Но не всякое столкновение приводит к взаимодействию; необходима энергия для разрыва старых связей. Избыток энергии, которым должны обладать молекулы реагирующих веществ для того, чтобы произошло взаимодействие, называется энергией активации реакции, Еакт. Так при взаимодействии молекул Н2 и Cl2 при достаточной энергии активации образуется промежуточное соединение, называемое активированным комплексом, существующее очень короткое время (10-8с). За это время в образующемся общем электронном облаке электронная плотность перераспределяется между атомами исходных веществ и продуктов реакции. Образование молекул хлороводорода НCl из молекул водорода и хлора можно представить схемой:
+ → →
Н2 Cl2 H … H Н-Cl
Н - Н Cl - Cl Cl…Cl Н-Cl
Чем больше величина Еакт., тем меньше молекул, обладающих такой энергией, тем меньше скорость реакции.
2) От концентрации реагирующих веществ. Чем больше частиц содержится в 1 единице объема, тем чаще происходит столкновение их, тем выше скорость реакции. Количественно эту зависимость описывает закон действия масс. Для гомогенной реакции, протекающей в одну стадию:
аА + bВ = сС + dD
скорость прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении реакции, т. е. υ = k СаА∙ СвВ, где СА и СВ – концентрации реагентов (моль/л), а k – коэффициент пропорциональности называемый константой скорости реакции. Физический смысл k: это скорость реакции при концентрациях веществ А и В, равных 1 моль/л (СА = СВ = 1 моль/л). Константа скорости реакции зависит от температуры и природы реагирующих веществ.
3) От температуры. Чем выше температура, тем больше активных молекул, и выше скорость реакции. Экспериментальное правило Вант-Гоффа позволяет рассчитывать скорость реакции по формуле:
(t2 - t1)/10
υ2 / υ1 = γ
где t2 и t1 – температуры (оС), которым соответствуют скорости υ2и υ1, а γ – температурный коэффициент скорости реакции, зависящий от природы веществ.
γ показывает, во сколько раз возрастает скорость реакции при увеличении температуры на 10 градусов. Экспериментально установлено, что величина γ лежит в интервале 2 – 4.
4) От наличия катализатора.
Катализатор – это вещество, ускоряющее или замедляющее химическую реакцию (участвует в ней, но не изменяет своего состава и количества). Так, в производстве серной кислоты окисление SO2(г) в SO3 (ж) происходит в присутствии катализатора NO (оксида азота (II))по следующим схемам:
2NO + O2 = 2NO2
NO2 + SO2 = SO3 + NO.
Чтобы понять, как «работает» катализатор, надо рассмотреть механизм каталитической реакции, протекающей в 2 стадии:
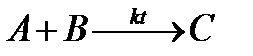 ,
,
I стадия: A + kt ® A…kt (активированный комплекс),
II стадия: A...kt + B ® C + kt.
Как видно из приведенной схемы, катализатор (kt) образует активированный промежуточный комплекс с одним из исходных веществ, ослабляя в нем энергию связей, тем самым снижая величину Еакт реакции и увеличивая ее скорость. В зависимости от агрегатного состояния катализатора различают гомогенный и гетерогенный катализ.
Для обратимых химических реакций, протекающих одновременно в двух направлениях:
А + В ↔ С + D,
закон действующих масс справедлив для прямой (υ1) и обратной (υ2) реакции:
υ1 = k1∙СА∙СВ и υ2 = k2 ∙СC ∙СD,
где k1 и k2 – константы их скоростей. В момент установления равновесия υ1 = υ2, тогда отношение констант скоростей k1 / k2 обозначается буквой Кр и называется константой химического равновесия. Таким образом, обратимая реакция описывается константой равновесия, причем при Кр >>1, реакция протекает в прямом, а при Кр<< 1 – в обратном направлении. Кp зависит от температуры и природы реагирующих веществ.
Для увеличения выхода продукта в таких процессах используется метод смещения химического равновесия, называемый принципом Ле Шателье: если на систему, находящуюся в химическом равновесии, указывать внешние воздействия (менять условия: концентрацию, давление, температуру), то происходящие в системе изменения это воздействие уменьшают.
Для реакций между газами, протекающей с изменением объема, увеличение внешнего давления смещает равновесие в сторону прямой реакции, если объем уменьшается, и в сторону обратной реакции, если объем увеличивается:
N2 + 3H2 ↔ 2NH3 , т.е. ↑Р →
Для химической реакции А + В ↔ С + D увеличение концентраций исходных веществ (А или В) смещает равновесие в сторону их уменьшения, т.е. образования продуктов, и наоборот, т.е.
↑Сисх →; ↑Спрод←.
Если прямая реакция: А + В → С, экзотермическая (∆Н <0), то увеличение температуры смещает равновесие в сторону ее уменьшения, т.е. обратной реакции (которая является эндотермической), т.е. ↑tо ←.
Катализатор ускоряет и прямую, и обратную реакцию, и не смещает химическое равновесие.
Выводы:
· Скорость химической реакции зависит от концентрации реагирующих веществ, возрастает с увеличением температуры и при использовании катализатора.
· Химические реакции могут протекать в одну (простые реакции) или несколько элементарных стадий (сложные реакции).
· Скорость обратимой реакции определяется разностью скоростей прямой и обратной реакции. Направление смещения химического равновесия определяется принципом Ле Шателье.
Отводимое для лекции время: 2 часа.
Литература:
1. Глинка Н.Л. Общая химия. – М.: Химия. 1986. – гл. VI, с. 163 - 183.
2. Коровин Н.В. Общая химия. – М.- Высш. шк., 2000. – §§ 7.1 - 7.5, с.167 - 195.
3. Фролов В.В. Химия. – М. – Высш. шк., 1979. – 5.1 - 5.6, с. 118 - 136.
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 450; Нарушение авторских прав?; Мы поможем в написании вашей работы!