
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие о зонной теории кристаллов
|
|
|
|
Химическую связь и свойства кристаллических веществ можно объяснить с позиций метода валентных связей (В.С.) и с использованием метода молекулярных орбиталей (ММО).
При образовании химической связи образуются молекулярные орбитали (МО), принадлежащие всей молекуле. Причем при сложении ΨАО возникают молекулярные орбитали с низкой энергией – связывающие, а при вычитании ΨАО – молекулярные орбитали с высокой энергией – разрыхляющие. При взаимодействии большого числа атомов и электронов образуется, и большое число молекулярных орбиталей и уменьшается разность энергий между ними. Происходит расщепление атомных орбиталей.
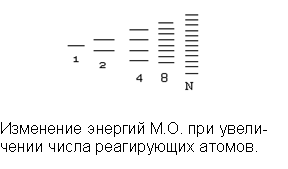
При образовании кристаллов в химические связи вступает огромное число частиц Ν и соответственно образуется огромное число МО, охватывающих весь кристалл, и разность между энергетическими уровнями становится мала. В результате образуются энергетические зоны, состоящие из огромного числа подуровней. Разность между верхней и нижней энергиями зоны называется шириной зоны.
В соответствии с принципом минимальной энергии, заполнение зон электронами происходит в порядке возрастания энергии, а согласно принципу Паули, на каждой молекулярной орбитали может быть размещено не более двух электронов с антипараллельными спинами. Соответственно в s – зоне – не более 2 N электронов, в р – зоне более 6 N электронов, а в d – зоне – не более 10 N электронов.
Верхняя зона, полностью заполненная электронами, называется валентной зоной. Зона, свободная от электронов и находящаяся по энергии выше валентной зоны, называется зоной проводимости.
Валентная зона и зона проводимости могут либо перекрываться, или не перекрываться друг с другом. Если зоны не перекрываются, то между ними существует запрещенная зона с шириной ∆ W.
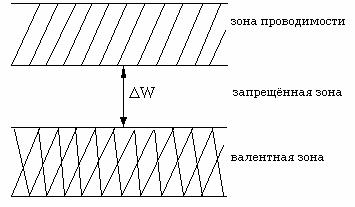
Для полупроводников ∆ W < 4 эВ, для диэлектриков ∆ W > 4 эВ (изоляторы).

В металлах запрещенная зона отсутствует.
Ширину запрещенной зоны определяет тип кристалла: металл, диэлектрик, полупроводник.
Металлы. У них валентные зоны и зоны проводимости перекрываются. У ѕ - и р - металлов перекрываются внешние ѕ - и р - орбитали. Так как число электронов на этих орбиталях меньше удвоенного числа молекулярных орбиталей, то имеется большое число незанятых молекулярных орбиталей в зоне проводимости. Энергии этих молекулярных орбиталей мало отличаются друг от друга, поэтому электроны при возбуждении легко переходят с одной молекулярной орбитали на следующую молекулярную орбиталь, а это обеспечивает высокуюэлектро- и теплопроводность.
При повышении температуры все большее число электронов переходит на вакантные молекулярные орбитали в зоне проводимости, что приводит к уменьшению числа вакантных молекулярных орбиталей и снижению электрической проводимости.
У d -элементов происходит перекрывание ns -, np - и (n - 1) d – зон. Однако, d – зона относительно неширокая, поэтому можно считать, что часть d – электронов в металлах локализованы, т.е. образуются ковалентные связи между соседними атомами и обусловливают повышение температуры плавления и механической прочности d – элементов и особенно элементов в середине и в конце периодов (IV – VIII групп) периодической системы.
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!