
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая термодинамика 1 страница
|
|
|
|
Тема 5. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ.
План занятия
Химическая термодинамика. Понятие химической системы. Типы химических систем: открытые, закрытые, изолированные. Равновесное состояние системы. Типы термодинамических процессов: обратимые, необратимые, самопроизвольные, равновесные. Основные понятия термодинамики: внутренняя энергия, работа, теплота. Первый закон термодинамики. Понятие энтальпии. Тепловой эффект реакции, экзотермические и эндотермические реакции. Термохимические уравнения и их особенности. Стандартные теплоты образования веществ. Закон Гесса, следствие из закона Гесса. Понятие энтропии. Второй и третий закон термодинамики. Самопроизвольные процессы. Энтальпийный и энтропийный факторы химических реакций. Энергия Гиббса.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Тепловой эффект реакции Q (кДж) – количество тепла, выделяющееся или поглощающееся в процессе химической реакции. При постоянном давлении тепловой эффект реакции равен изменению энтальпии системы, взятой с обратным знаком и обозначается как 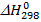 . Как правило, в термодинамических расчетах используются стандартные величины – то есть величины, определенные при стандартных условиях (температура 298 К, давление 105 Па)
. Как правило, в термодинамических расчетах используются стандартные величины – то есть величины, определенные при стандартных условиях (температура 298 К, давление 105 Па)
Энтальпия H (кДж/моль) - это термодинамическая функция, характеризующая теплосодержание системы при постоянном давлении.
Согласно закону Гесса, тепловой эффект химической реакции не зависит от пути ее протекания, а зависит только от начального и конечного состояния веществ.
Расчет теплового эффекта реакции производится согласно следствию из закона Гесса: тепловой эффект реакции равен разности сумм энтальпий образования продуктов реакции и энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции: 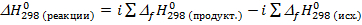 , где i – стехиометрические коэффициенты в уравнении реакции.
, где i – стехиометрические коэффициенты в уравнении реакции.
Для расчета теплового эффекта используются стандартные энтальпии (стандартные теплоты) образования вещества 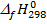 (кДж/моль) – это тепловой эффект реакции образования 1 моля вещества из простых веществ при стандартных условиях, взятый с обратным знаком. Например, при образовании 1 моля HCl из простых веществ при стандартных условиях выделяется количество тепла, равное 92,3 кДж/моль.
(кДж/моль) – это тепловой эффект реакции образования 1 моля вещества из простых веществ при стандартных условиях, взятый с обратным знаком. Например, при образовании 1 моля HCl из простых веществ при стандартных условиях выделяется количество тепла, равное 92,3 кДж/моль.
½ Cl2 + ½ H2 = HCl + 92,3 кДж
Таким образом, стандартная энтальпия образования HCl равна 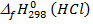 = -92,3 кДж/моль. Эти величины определены для многих веществ и являются справочными данными.
= -92,3 кДж/моль. Эти величины определены для многих веществ и являются справочными данными.
Реакции могут сопровождаться выделением или поглощением тепла. Если в результате реакции энтальпия химической системы понижается (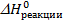 <0), то происходит выделение тепла (Q > 0) и такая реакция называется экзотермической. Если в результате реакции энтальпия системы повышается (
<0), то происходит выделение тепла (Q > 0) и такая реакция называется экзотермической. Если в результате реакции энтальпия системы повышается (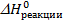 > 0), то происходит поглощение тепла (Q < 0) и такая реакция называется эндотермической.
> 0), то происходит поглощение тепла (Q < 0) и такая реакция называется эндотермической.
Термохимическое уравнение – уравнение, в котором указывается тепловой эффект реакции. В правой части уравнения указывается значение 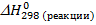 . При этом для удобства могут использоваться дробные стехиометрические коэффициенты.
. При этом для удобства могут использоваться дробные стехиометрические коэффициенты.
½ Cl2 +1/2 H2 = HCl, 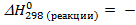 92,3 кДж
92,3 кДж
Самопроизвольный процесс – процесс, который может осуществляться в системе без воздействия со стороны окружающей среды.
Критерием самопроизвольного протекания химической реакции при данных условиях является изменение энергии Гиббса 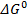 (кДж/моль), которое рассчитывается по формуле:
(кДж/моль), которое рассчитывается по формуле:
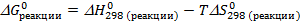
Где 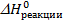 - это изменение энтальпии в процессе реакции или тепловой эффект реакции;
- это изменение энтальпии в процессе реакции или тепловой эффект реакции; 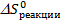 - это изменение энтропии в процессе реакции. Движущей силой реакции является уменьшение энергии системы в процессе реакции, т.е. как правило, самопроизвольно идут экзотермические процессы, где
- это изменение энтропии в процессе реакции. Движущей силой реакции является уменьшение энергии системы в процессе реакции, т.е. как правило, самопроизвольно идут экзотермические процессы, где 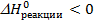 . Однако и эндотермические реакции могут идти самопроизвольно, т.к. самопроизвольность процесса определяется не только изменением энергии в системе. В то же время движущей силой реакции является увеличение меры беспорядка системы, за которую отвечает термодинамическая функция S (Дж/моль·K), называемая энтропией. Согласно 2 закону термодинамики, самопроизвольно идут те процессы, которые сопровождаются ростом энтропии, т.е.
. Однако и эндотермические реакции могут идти самопроизвольно, т.к. самопроизвольность процесса определяется не только изменением энергии в системе. В то же время движущей силой реакции является увеличение меры беспорядка системы, за которую отвечает термодинамическая функция S (Дж/моль·K), называемая энтропией. Согласно 2 закону термодинамики, самопроизвольно идут те процессы, которые сопровождаются ростом энтропии, т.е.  . Изменение энтропии в процессе химической реакции определяется аналогично закону Гесса и равно разности сумм энтропий продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов i:
. Изменение энтропии в процессе химической реакции определяется аналогично закону Гесса и равно разности сумм энтропий продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов i:
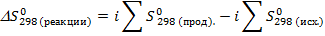
Для расчета используются стандартные энтропии веществ 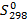 (Дж/моль·K), которые определены для многих соединений и являются справочными величинами.
(Дж/моль·K), которые определены для многих соединений и являются справочными величинами.
Энергия Гиббса включает два этих фактора, и может принимать разные значения. Если ΔG<0, то химическая реакция протекает при данных условиях самопроизвольно в прямом направлении, т.е. в сторону образования продуктов реакции. Наиболее вероятно протекание той реакции, у которой более отрицательное значение ΔG. При разных температурах значения ΔG для одной и той же реакции будут отличаться, при этом наиболее вероятно протекание при той температуре, при которой ΔG будет иметь большее отрицательное значение. Если же ΔG > 0, то реакция самопроизвольно в прямом направлении протекать не будет, но возможно ее протекание в обратном направлении. При ΔG = 0 система будет находиться в состоянии химического равновесия, т.е. возможно протекание и прямой и обратной реакции.
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Задача №1.
Вычислите тепловой эффект реакции, запишите термохимическое уравнение реакции.
2Mg (тв) + CO2 (г) = 2MgO (тв) + C (графит)
Определить, сколько теплоты выделиться при сгорании 1 кг магния по этой реакции.
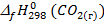 = -393,5 кДж/моль;
= -393,5 кДж/моль; 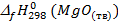 = -601,6 кДж/моль
= -601,6 кДж/моль
Алгоритм решения
1. Тепловой эффект реакции 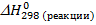 определяем согласно следствию из закона Гесса. Для этого нам необходимы справочные данные по энтальпиям образования веществ, участвующих в реакции. Для простых веществ (Mg, C) энтальпии образования
определяем согласно следствию из закона Гесса. Для этого нам необходимы справочные данные по энтальпиям образования веществ, участвующих в реакции. Для простых веществ (Mg, C) энтальпии образования 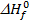 как правило, равны нулю.
как правило, равны нулю.
Записываем выражение для расчета теплового эффекта реакции 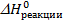 :
:
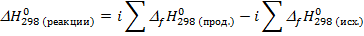
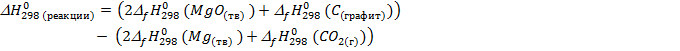
(учитываем стехиометрические коэффициенты в уравнении реакции: по уравнению реакции из 2 моль Mg и 1 моль CO2 образуется 2 моль MgO и 1 моль C)
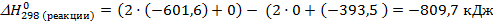
2. Запишем термохимическое уравнение реакции:
2Mg (тв) + CO2 (г) = 2MgO (тв) + C (графит), 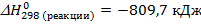
(Q > 0, реакция экзотермическая)
Таким образом, эта реакция экзотермическая, происходит выделение тепла.
3. Итак, согласно уравнению реакции при сгорании 2 молей Mg выделяется 809,7 кДж тепла. Для того чтобы определить количество тепла Q, выделяемое при сгорании 1 кг Mg в этой реакции, переведем массу магния в количество вещества.
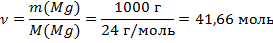
Составляем пропорцию:
2 моль Mg – 809,7 кДж
41,66 моль Mg – x кДж
Таким образом, количество теплоты Q, выделившееся в результате сгорания 1 кг Mg составляет:
Q =x = 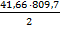 = 16866 кДж
= 16866 кДж
Ответ: 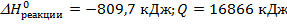
Задача №2
В каком направлении может протекать реакция при температуре 27 0С?
NiO (тв) + Pb (тв) = Ni (тв) + PbO (тв)
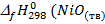 ) = -239,7 кДж/моль;
) = -239,7 кДж/моль; 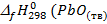 )= -219 кДж/моль
)= -219 кДж/моль
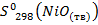 = 38 Дж/моль·К;
= 38 Дж/моль·К; 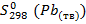 = 64,8 Дж/моль·К;
= 64,8 Дж/моль·К; 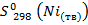 = 29,9 Дж/моль·К;
= 29,9 Дж/моль·К; 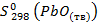 = 66,5 Дж/моль·К.
= 66,5 Дж/моль·К.
Алгоритм решения.
Для того, чтобы определить направление процесса, необходимо вычислить изменение энергии Гиббса в процессе реакции 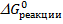 по уравнению
по уравнению
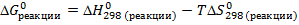
1. Сначала определяем 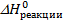 согласно следствию из закона Гесса:
согласно следствию из закона Гесса:
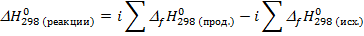
Т.к. перед веществами в уравнении реакции все коэффициенты равны 1, то в выражении для 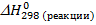 мы их не учитываем.
мы их не учитываем.
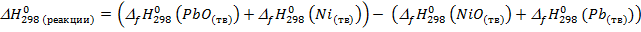
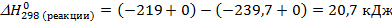
2. Определяем 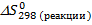 , учитывая, что энтропия вещества не может быть равна нулю при стандартных условиях.
, учитывая, что энтропия вещества не может быть равна нулю при стандартных условиях.
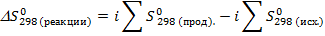
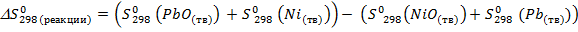
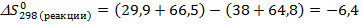 Дж/K
Дж/K
3. Находим изменение энергии Гиббса по уравнению
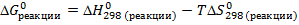
Температуру необходимо перевести в K. Переводим следующим образом:
T = 273+27 = 300 K
При расчете необходимо учесть, что величины 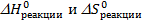 имеют разные единицы измерения.
имеют разные единицы измерения.
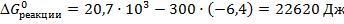
Т.к. полученное значение 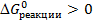 , значит реакция в прямом направлении при данной температуре не протекает. Возможно протекание этой реакции в обратном направлении.
, значит реакция в прямом направлении при данной температуре не протекает. Возможно протекание этой реакции в обратном направлении.
Ответ: реакция может протекать в обратном направлении.
Задача №3.
При какой температуре данная реакция пойдет: а) в прямом направлении; б) в обратном направлении; в) в прямом и обратном направлениях одновременно
CaCO3 (г) 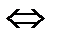 CaO (тв) + CO2(г)
CaO (тв) + CO2(г)
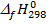 (CaCO3(тв)) = -1207 кДж/моль;
(CaCO3(тв)) = -1207 кДж/моль; 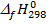 (CaO (тв))=-634,9 кДж/моль;
(CaO (тв))=-634,9 кДж/моль; 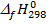 (CO2(г)) =-393,5 кДж/моль
(CO2(г)) =-393,5 кДж/моль
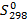 (CaCO3(тв)) =88 Дж/моль·К;
(CaCO3(тв)) =88 Дж/моль·К; 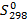 (CaO (тв))= 38,1 Дж/моль·К;
(CaO (тв))= 38,1 Дж/моль·К; 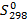 (CO2(г)) =213,8 Дж/моль·К
(CO2(г)) =213,8 Дж/моль·К
Алгоритм решения
а) Реакция пойдет в прямом направлении при условии, что 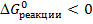 .
.
1.Сначала определяем 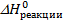 согласно следствию из закона Гесса:
согласно следствию из закона Гесса:
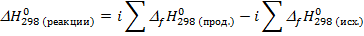
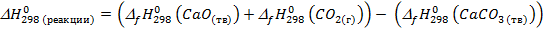
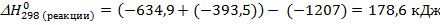
2.Определяем 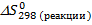 :
:
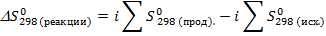
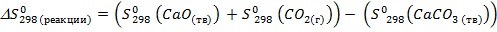
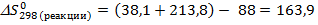 Дж/K
Дж/K
3. Исходя из уравнения для расчета изменения энергии Гиббса, составим неравенство:
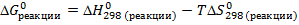
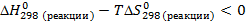
Подставим найденные значения и решим неравенство:
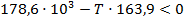
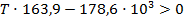
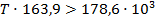
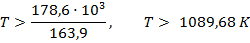
Реакция будет идти в прямом направлении при температуре выше 1089,68 К, т.е. при достаточно высоких температурах.
б) Реакция пойдет в обратном направлении при условии, что 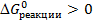 .
.
Исходя из уравнения для расчета изменения энергии Гиббса, составим неравенство:
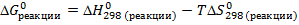
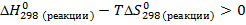
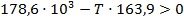
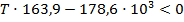
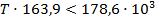
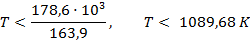
Реакция будет идти в обратном направлении при температуре ниже 1089,68 К, т.е. при относительно низких температурах.
в) Реакция будет находиться в равновесии, т.е. будет идти одновременно и в прямом, и в обратном направлении при условии, что 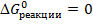 .
.
Исходя из уравнения для расчета изменения энергии Гиббса, составим неравенство:
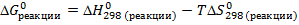
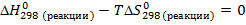
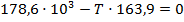
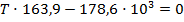
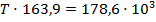
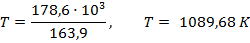
Реакция будет идти и в прямом, и в обратном направлении при температуре 1089,68 К.
Ответ: а) Т > 1089,68 K; б) Т < 1089,68 K; в) Т = 1089,68 К
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №1
1. Рассчитайте тепловой эффект реакции образования оксида углерода (IV), запишите термохимическое уравнение реакции.
C(графит) + O2(г) = CO2(г)
Сколько углерода и сколько кислорода (в граммах) вступило в реакцию, при которой выделилось 39,35 кДж теплоты?
2. Рассчитав изменение энергии Гиббса, установите, возможно ли самопроизвольное протекание реакции при 27 0С.
Cu (тв) + ZnO (тв) = CuO (тв) + Zn (тв)
3. Покажите расчетом, при каких температурах реакция будет протекать в обратном направлении.
2SO2(г) +O2(г) =2SO3(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №2
1. Рассчитайте тепловой эффект реакции образования оксида кальция, запишите термохимическое уравнение реакции. Сколько теплоты выделится при сгорании 200 граммов кальция?
2Ca(тв) + O2(г) = 2CaO(тв)
2. Рассчитав значение изменения энергии Гиббса, установите, в каком направлении может протекать реакция при 25 0С:
Cu (тв) + PbO (тв) = Pb (тв) + CuO (тв)
3. Покажите расчетом, при каких температурах возможно протекании реакции в прямом направлении.
2ZnS(тв) + 3O2(г) = 2ZnO(тв) + 2SO2(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №3
1. Рассчитайте тепловой эффект реакции горения метана, запишите термохимическое уравнение реакции. Сколько тепла выделится или поглотится при сгорании 11 г метана?
CH4(г)+2O2(г) = CO2(г) + 2H2O(г)
2. Рассчитав изменение энергии Гиббса, установите, при какой температуре наиболее вероятно протекание данной реакции - при 100 0С или при 1000 0С?
2Ba(NO3)2(т) = 2BaO(тв)+4NO2(г)+O2(г)
3. Покажите расчетом, при какой температуре реакция будет протекать и в прямом, и в обратном направлении одновременно.
2AgNO3(тв) = 2Ag(тв) + 2NO2(г) + O2(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №4
1. Рассчитайте тепловой эффект реакции, запишите термохимическое уравнение реакции. Сколько бария и кислорода в граммах вступило в реакцию, если в ходе неё выделилось 2740 кДж теплоты?
2Ba(тв) + O2(г) = 2BaO(тв)
2. Рассчитав изменение энергии Гиббса, установите, при какой температуре наиболее вероятно протекание данной реакции – при 25 0С или при 100 0С?
ZnO(тв) + CO(г) = Zn(тв) +CO2(г)
3. Покажите расчетом, при каких температурах возможно протекании реакции в прямом направлении.
N2(г) + O2(г) = 2NO(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №5
1. Рассчитайте тепловой эффект реакции образования углекислого газа, запишите термохимическое уравнение реакции. Сколько граммов CO2 образовалось, если в результате реакции выделилось 327,9 кДж теплоты?
C(графит) + O2(г) = CO2(г)
2. Рассчитав изменение энергии Гиббса, установите, в каком направлении может протекать реакция при 25 0С.
6Al (тв) + 3Fe2O3 (тв) = 6Fe (тв) + 3Al2O3 (тв)
3. Покажите расчетом, при каких температурах возможно протекании реакции в прямом направлении.
SO2(г) + 2H2S(г) = 3S(тв) +2H2O(ж)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №6
1. Рассчитайте тепловой эффект реакции взаимодействия кальция с водой, запишите термохимическое уравнение реакции. Сколько теплоты выделяется или поглощается при получении 100 литров водорода (н.у.)?
Ca(тв)+2H2O(ж) = Ca(OH)2(тв) + H2(г)
2. Рассчитав изменение энергии Гиббса, установите, какая из двух реакций окисления меди более вероятна при 300 0С:
1) Cu (тв) + ½ O2(г) = CuO (тв);
2) 2Cu (тв) + ½ O2(г) = Cu2O (тв).
3. Покажите расчетом, при какой температуре реакция будет протекать и в прямом, и в обратном направлении одновременно.
2PbS(тв) + 3O2(г) = 2PbO(тв) + 2SO2(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №7
1. Рассчитайте тепловой эффект реакции горения сероводорода, запишите термохимическое уравнение реакции.
H2S(г) + 3/2O2(г) =SO2(г) + H2O(г)
Сколько тепла выделяется при сгорании 1м3 сероводорода (н.у.)?
2. Рассчитав значение энергии Гиббса, установите, какая из реакций наиболее вероятна при стандартной температуре.
1) FeO(тв) + C(графит) = Fe(тв) + CO(г);
2) FeO(тв) + CO(г) = Fe(тв) + CO2(г).
3. Покажите расчетом, при каких температурах возможно протекании реакции в прямом направлении.
3NiO(тв) + 2Al(тв) = 3Ni(тв) + Al2O3(тв)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №8
1. Рассчитайте тепловой эффект реакции образования бензола, запишите термохимическое уравнение реакции.
3C2H2(г) = C6H6(ж)
Сколько тепла выделится при образовании 1 кг бензола?
2. Рассчитав изменение энергии Гиббса, установите, какая из двух реакций более вероятна при 27 0С.
1) CaCl2(тв) + F2(г) = CaF2(тв) + Cl2(г)
2) CaF2(тв) + Cl2(г) = CaCl2(тв) + F2(г)
3. Покажите расчетом, при какой температуре реакция будет протекать и в прямом, и в обратном направлении одновременно.
8Al(тв) + 3Fe3O4(тв) = 9Fe(тв) + 4Al2O3(тв)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №9
1. Рассчитайте тепловой эффект реакции образования оксида меди (II), запишите термохимическое уравнение реакции. Вычислите массу меди, которая прореагировала, если в результате реакции выделилось 12,8 кДж тепла.
2Cu(тв) + O2(г) = 2CuO(тв)
2. Рассчитав изменение энергии Гиббса, установите, возможно ли самопроизвольное протекание реакции при температуре 25 0С?
CaO(тв) + H2O(г) = Ca(OH)2(тв)
3. Покажите расчетом, при каких температурах эта реакция будет идти в обратном направлении.
N2(г)+O2(г)=2NO(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №10
1. Рассчитайте тепловой эффект реакции образования сульфида железа (II), запишите термохимическое уравнение реакции. Сколько железа в граммах вступило в реакцию, в ходе которой выделилось 3,77 кДж?
Fe(тв) + S(тв) = FeS(тв)
2. Рассчитав изменение энергии Гиббса, установите, какая из двух реакций более вероятна при стандартной температуре.
1) H2S(г) + Cl2(г) = 2HCl(г) + S(тв)
2) H2S(г) + I2(г) = 2HI(г) + S(тв)
3. Покажите расчетом, при какой температуре реакция будет протекать и в прямом, и в обратном направлении одновременно.
C(графит) + H2O(г) = CO(г) +H2(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №11
1. Рассчитайте тепловой эффект реакции разложения оксида меди (I), запишите термохимическое уравнение реакции. Определить массу оксида меди (I), участвовавшего в реакции, если на разложение было затрачено 17 кДж тепла.
2Cu2O(тв)→ t 4Cu(тв) + O2(г)
2. Рассчитав изменение энергии Гиббса, установите, возможно ли самопроизвольное протекание реакции при температуре 250С и если повысить температуру до 300 0С.
Cd(тв) + 2AgCl(тв) = 2Ag (тв) + CdCl2(тв)
3. Покажите расчетом, при каких температурах возможно протекании реакции в прямом направлении.
4HCl(г) +O2(г) = 2Cl2(г) +2H2O(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №12
1. Определить тепловой эффект реакции горения метана и вычислить, сколько тепла выделяется при сжигании 100 литров СН4 (н.у.).
CH4(г)+2O2(г) = CO2(г) + 2H2O(г)
2. Рассчитав изменение энергии Гиббса, установите, возможно ли самопроизвольное протекание реакции при температуре 100 0С?
2NaHCO3(тв)=Na2CO3(тв)+H2O(г)+CO2(г)
3. Покажите расчетом, при каких температурах возможно протекание реакции в прямом направлении.
4HF(г) + O2(г) = 2F2(г) + 2H2O(г)
Индивидуальное задание «Энергетика химических процессов. Химическая термодинамика»
ВАРИАНТ №13
1. Рассчитайте тепловой эффект реакции образования оксида серы (IV), запишите термохимическое уравнение реакции. Вычислите массу прореагировавшей серы, если в результате реакции выделилось 92,8 кДж теплоты.
S(тв) + O2(г) = SO2(г)
2. Рассчитав изменение энергии Гиббса, установите, возможно ли самопроизвольное протекание реакции при 35 0С.
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 6493; Нарушение авторских прав?; Мы поможем в написании вашей работы!