
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач
|
|
|
|
Задача 1. Гелий массой 75 г нагревали при температуре 100°С и давлении 1,013 · 105 Па. Вычислить количество затраченной теплоты, если объем газа изменился от 3 до 15 л.
Решение.
Так как нагревание газа происходит изотермически и изобарически, то количество затраченной теплоты можно вычислить по уравнению
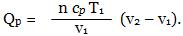
n(He) = 75/4 = 18,75 моль.
Для одноатомных газов c v = 3/2 R, c p = 5/2 R, для двухатомных - c v = 5/2 R, c p = 7/2 R.
Гелий - одноатомный газ, поэтому c р =5/2R = 5/2 · 8,314 = 20,79 Дж/моль.
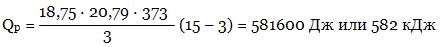
Задача 2. Вычислить тепловой эффект при постоянном давлении и постоянном объеме в стандартных условиях реакции
С2Н5ОН (ж) + О2 = СН3СООН (ж) + Н2О.
Решение.
Так как реакция горения, то тепловой эффект удобнее рассчитать по тепловым эффектам сгорания участвующих в реакции веществ.
Тепловые эффекты сгорания веществ находим в справочнике:
ΔHсгор(С2Н5ОН) = - 1367,7 кДж
ΔHсгор(СН3СООН) = - 872,1 кДж
ΔHсгор(Н2О) = 0
ΔHх.р. = ∑ (ΔHсгор.)исх. - ∑ (ΔHсгор.)прод.
ΔHх.р. = -1367,7 - (- 872,1) = - 495,6 кДж/моль
Задача 3. При восстановлении алюминием железа из 100 г оксида железа (III) выделилось 476 кДж энергии. Определить тепловой эффект реакции.
Решение.
100 г 476 кДж
Fe2O3 + 2Al = 2Fe + Al2O3 + Q
1 моль
160 г
100 г Fe2O3 выделяют 476 кДж
160 г Fe2O3 - х кДж
x=160 · 476 / 100 = 761,6 кДж
Термохимическое уравнение:
Fe2O3 + 2Al = 2Fe + Al2O3 + 761,6 кДж
Задача 4. Пользуясь справочными данными, установить, возможно ли при температурах 298 и 2500 К восстановление диоксида титана до свободного металла по схеме:
TiO2 (к.) + 2C (графит) = Ti (к.) + 2CO (г.).
Зависимостью ΔH° и ΔS° от температуры пренебречь.
Решение.
1) Определяем ΔG° по уравнению ΔG°298 = ∑ (ΔG°обр.)прод. - ∑ (ΔG°обр.)исх..
ΔG° (TiO2) = -888,6 кДж/моль
ΔG° (CO) = -137,1 кДж/моль
ΔG°298 = -137,1 · 2 - (-888,6) = 614,4 кДж
Поскольку ΔG°298 > 0, восстановление TiO2 при 298 К невозможно.
2) Для расчета ΔG2500 воспользуемся уравнением ΔG = ΔH° - T · ΔS°.
По справочнику находим значения ΔH0 и ΔS0 для всех веществ. ΔH° (TiO2) = -943,9 кДж/моль; ΔH° (CO) = -110,5 кДж/моль.
ΔS° (TiO2) = 50,3 Дж/моль · К; ΔS° (С) = 5,7 Дж/моль · К; ΔS° (Ti) = 30,6 Дж/моль · К; ΔS° (СО) = 197,5 Дж/моль · К.
ΔH° = -110,5 · 2 - (-943,9) = 722,9 кДж
ΔS° = 30,6 + 197,5 · 2 - 50,3 - 5,7 · 2 = 363,9 Дж/К
Теперь находим ΔG2500, выражая ΔS° в кДж/К:
ΔG2500 = ΔH2500 - T · ΔS2500 = 722, 9 - 2500 · 363,9 / 1000 = -186,9 кДж.
Таким образом, ΔG2500 < 0, так что восстановление TiO 2 графитом при 2500 К возможно.
Вопросы и задачи для самоконтроля
Начало формы
- Что такое система? Какие ее виды различают? Приведите примеры.
- Что такое энтальпия и какова ее связь с внутренней энергией?
- Дайте определения обратимым и необратимым термодинамическим процессам. Приведите примеры.
- Определите затраченную теплоту и совершенную работу изобарического (1,013 · 105 Па) расширения кислорода объемом от 0,005 м3 при 20°С до 0,00551 м3 при 50°С.
- Какова будет работа адиабатического сжатия 1 моль азота, если при этом температура повысилась от 0 до 50°С?
- Что такое энтропия? Почему энтропия системы всегда больше нуля?
- В чем состоит физический смысл изобарно-изотермического и изохорно-изотермического потенциалов?
- Вычислите тепловой эффект реакции при 250С:
СаС2(т) + 2Н2О(ж) = Са(ОН)2(т) + С2Н2(г)
- Определите стандартную энтропию реакции сгорания метана:
СН4 + 2О2 = СО2 + 2Н2О(г)
- Рассчитать значения ΔG°298 следующих реакций и установить, в каком направлении они могут протекать самопроизвольно в стандартных условиях при 25°С:
а) NiO (т.) + Pb (т.) = Ni (т.) + PbO (т.)
б) Pb (т.) + CuO (т.) = PbO (т.) + Cu (т.)
в) 8Al (т.) + 3Fe3O4 (т.) = 9Fe (т.) + 4Al2O3 (т.)
Конец формы
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 3810; Нарушение авторских прав?; Мы поможем в написании вашей работы!