
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изохорный процесс
|
|
|
|
Изохорический или изохорный процесс (от др.-греч. ἴσος «равный» и χώρος «место») — термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля не выполняется.
Из определения работы следует, что изменение работы при изохорном процессе равно:
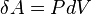
Чтобы определить полную работу процесса проинтегрируем данное выражение. Поскольку объем неизменен, то:
 ,
,
Но такой интеграл равен нулю. Итак, при изохорном процессе газ работы не совершает:
 .
.
Изменение внутренней энергии идеального газа можно найти по формуле:
 ,
,
где i — число степеней свободы, которое зависит от количества атомов в молекуле (3 для одноатомной (например, неон), 5 для двухатомной (например,кислород) и 6 для трёхатомной и более (например, молекула водяного пара)).
Из определения и формулы теплоёмкости и, формулу для внутренней энергии можно переписать в виде:
 ,
,
где  — молярная теплоёмкость при постоянном объёме.
— молярная теплоёмкость при постоянном объёме.
Используя первое начало термодинамики можно найти количество теплоты при изохорном процессе:

Но при изохорном процессе газ не выполняет работу. То есть, имеет место равенство:
 ,
,
то есть вся теплота, которую получает газ идёт на изменение его внутренней энергии.
Энтропия при изохорном процессе[править | править вики-текст]
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:

Выше была выведена формула для определения количества теплоты. Перепишем ее в дифференциальном виде:
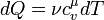 ,
,
где ν — количество вещества, 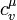 — молярная теплоемкость при постоянном объеме. Итак, микроскопическое изменение энтропии при изохорном процессе можно определить по формуле:
— молярная теплоемкость при постоянном объеме. Итак, микроскопическое изменение энтропии при изохорном процессе можно определить по формуле:

Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе:

В данном случае выносить выражение молярной теплоемкости при постоянном объеме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 1041; Нарушение авторских прав?; Мы поможем в написании вашей работы!