
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коми филиал
|
|
|
|
Государственного бюджетного образовательного учреждения высшего профессионального образования «КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Министерства здравоохранения и социального развития Российской Федерации
Кафедра химии, физики, биологии
Методические указания для студентов 1 курса
Специальности (направления подготовки) 060101 – Лечебное дело
по самостоятельной внеаудиторной работе
по дисциплине Основы биоорганической химии
ТЕМА: Основы химической термодинамики.
ЦЕЛЬ: Ознакомиться с основными термодинамическими параметрами: энтальпия, энтропия, энергия Гиббса.
ЗАДАЧИ:
1. Проработать теоретический материал по теме занятия.
2. Подготовиться к лабораторной работе «Определение энтальпии различных химических процессов».
СТУДЕНТ ДОЛЖЕН ЗНАТЬ:
1. до изучения темы: Экзо- и эндотермические процессы.
2. после изучения темы: Первый и второй законы термодинамики, роль энтальпийного и энтропийного факторов для самопроизвольного протекании химической реакции. Калорийность продуктов питания.
СТУДЕНТ ДОЛЖЕН УМЕТЬ: Определять возможность самопроизвольного протекания реакции в различных условиях с использование законов термодинамики.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ВНЕАУДИТОРНОЙ РАБОТЫ СТУДЕТОВ ПО УКАЗАННОЙ ТЕМЕ
1) Ознакомиться с теоретическим материалом по теме занятия с использование конспектов лекций и рекомендуемой учебной литературы.
2) Ответить на вопросы самоконтроля
1. Что называется «термодинамической системой»
2. По каким признакам термодинамические системы делят на изолированные, закрытые, открытые.
3. Приведите формулировку и математическое выражение I начала термодинамики для: а) изолированной системы; б) неизолированной системы.
4. При каких условиях изменение энтальпии ΔН равно теплоте, получаемой системой из окружающей среды.
5. В каких случаях ΔН = ΔU и QV = QP.
6. Что называют тепловым эффектом реакции.
7. Какие процессы называются самопроизвольными.
3) Проверить свои знания с помощью тестового контроля
1. Термодинамика изучает:
1) скорости протекания химических превращений и механизмы этих превращений;
2) энергетические характеристики физических и химических процессов и способность химических систем выполнять полезную работу;
3) условия смещения химического равновесия;
4) влияние катализаторов на скорость биохимических процессов.
2. Открытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
3. Закрытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
4. Изолированной системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией;
5. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещенной в термостат?
1) изолированной; 2) открытой; 3) закрытой; 4) стационарной.
6. К какому типу термодинамических систем принадлежит живая клетка?
1) открытой; 2) закрытой; 3) изолированной; 4) равновесной.
7. Какие величины являются функциями состояния системы: a) внутренняя энергия; б) работа; в) теплота; г) энтальпия; д) энтропия.
1) а, г, д; 2) б, в; 3) все величины; 4) а, б, в, г.
8. Отражает связь между работой, теплотой и внутренней энергией системы:
1) второй закон термодинамики; 2) закон Гесса;
3) первый закон термодинамики; 4) закон Вант – Гоффа.
9. Первый закон термодинамики отражает связь между:
1) работой, теплотой и внутренней энергией;
2) свободной энергией Гиббса, энтальпией и энтропией системы;
3) работой и теплотой системы;
4) работой и внутренней энергией.
10. Укажите формулировку закона Гесса:
1) тепловой эффект реакции зависит только от начального и конечного состояния системы инее зависит от пути реакции;
2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы;
3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системой;
4) тепловой эффект реакции не зависит от начального и конечного состояния системы, а зависит от пути реакции.
11. Математическим выражением первого закона термодинамики для закрытых систем является:
1) ΔU = 0 2) ΔU = Q ̶ р·ΔV 3) ΔG = ΔH ̶ T · ΔS 4) ΔS > 0
12. Тепловой эффект реакции, протекающий при постоянном объеме, называется изменением:
1) энтальпии; 2) внутренней энергии; 3) энтропии; 4) свободной энергии Гиббса.
13. Энтальпия реакции – это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно – изотермических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно – изотермических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
14. Химические процессы, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, называются:
1) эндотермическими; 2) экзотермическими;
3) экзэргоническими; 4) эндэргоническими.
15. Тепловой эффект реакции, протекающий при постоянном давлении, называется изменением:
1) внутренней энергии; 2) энтропии; 3) энтальпии;
4) ни одно из предыдущих определений неверно.
16. Процессы называются эндотермическими:
1) для которых ΔН отрицательно; 2) для которых ΔG отрицательно;
3) для которых ΔН положительно; 4) для которых ΔG положительно.
17. Процессы называются экзотермическими:
1) для которых ΔН отрицательно; 2) для которых ΔG отрицательно;
3) для которых ΔН положительно; 4) для которых ΔG положительно.
18. Какой закон лежит в основе расчетов калорийности продуктов питания?
1) Вант – Гоффа; 2) Гесса; 3) Сеченова; 4) Рауля.
19. При окислении, каких веществ в условиях организма выделяется большее количества энергии?
1) белков; 2) жиров; 3) углеводов; 4) углеводов и белков.
20. Самопроизвольным называется процесс, который:
1) осуществляется без помощи катализатора;
2) сопровождается выделением теплоты;
3) осуществляется без затраты энергии извне;
4) протекает быстро.
21. Энтропии реакции – это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно – изотермических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно – изотермических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц.
22. Тенденция системы к достижению вероятного состояния, которому соответствует максимальная беспорядочность распределения частиц, характеризуется функцией состояния:
1) энтальпией; 2) энтропией;
3) энергией Гиббса; 4) внутренней энергией.
23. В каком соотношении находятся энтропии трех агрегатных состояний одного вещества: газа, жидкости, твердого тела:
1) S (г) > S (ж) > S (г); 2) S (тв.) > S (ж) > S (г); 3) S (ж) > S (г) > S (тв.)
4) агрегатное состояние не влияет на значение энтропии.
24. Наибольшее положительное изменение энтропии должно наблюдаться в случае:
1) СН3ОН (тв.) → СН3ОН (г); 2) СН3ОН (тв.) → СН3ОН (ж);
3) СН3ОН (г) → СН3ОН (тв.); 4) СН3ОН (ж) → СН3ОН (тв.)
25. Энтропия системы увеличивается при:
1) повышении давления;
2) переходе от жидкого к твердому агрегатному состоянию;
3) повышении температуры;
4) переходе от газообразного к жидкому состоянию.
26. Математическим выражением 2-го закона термодинамики для изолированных систем является:
1) ΔU = 0; 2) ΔS ≥ 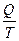 ; 3) ΔS ≤
; 3) ΔS ≤ 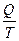 ; 4) ΔН = 0.
; 4) ΔН = 0.
27. Процессы называют эндэргоническими, если:
1) ΔН < 0; 2) ΔG < 0; 3) ΔН > 0; 4) ΔG > 0.*
28. Процессы называют экзэргоническими, если:
1) ΔН < 0; 2) ΔG < 0; 3) ΔН > 0 4) ΔG > 0
29. Самопроизвольный характер процесса лучше определять путем оценки:
1) энтропии; 2) энтальпии; 3) свободной энергии Гиббса; 4) температуры.
30. Для предсказания возможности самопроизвольного протекания процессов в живом организме можно использовать термодинамическую функцию:
1) энтальпию; 2) энтропию;
3) внутреннюю энергию; 4) свободную энергию Гиббса.
31. Укажите знак ΔG процесса таяния льда при 263 К?
1) ΔG > 0; * 2) ΔG = 0; 3) ΔG < 0; 4) ΔG ≤ 0.
32. Реакция неосуществима при любых температурах в случае:
1) ΔН > 0 и ΔS > 0; 2) ΔН > 0 и ΔS < 0;
3) ΔН < 0 и ΔS < 0; 4) ΔН = 0 и ΔS = 0.
33. Реакция возможна при любых температурах в случае:
1) ΔН < 0 и ΔS > 0; 2) ΔН < 0 и ΔS < 0;
3) ΔН > 0 и ΔS > 0; 4) ΔН = 0 и ΔS = 0.
34. Если ΔН < 0 и ΔS < 0, то, реакция может протекать самопроизвольно в случае:
1) [ΔН] > [T·ΔS]; 2) при любых соотношениях ΔН и Т·ΔS;
3) [ΔН] < [T·ΔS]; 4) [ΔН] = [T·ΔS].
35. При каких значениях по знаку ΔН и ΔS в системе возможны только экзотермические процессы?
1) ΔН > 0, ΔS > 0; 2) ΔН < 0, ΔS > 0; 3) ΔН < 0, ΔS < 0; 4) ΔН > 0, ΔS < 0.
36. При каких соотношениях ΔН и Т·ΔS химический процесс направлен в сторону эндотермической реакции?
1) ΔН < Т·ΔS; 2) ΔН > Т·ΔS; 3) ΔН = Т·ΔS; 4) ΔН Т·ΔS
37. Калорийностью питательных веществ называется энергия:
1) выделяемая при полном окислении 1 г питательных веществ;
2) выделяемая при полном окислении 1 моль питательных веществ;
3) необходимая для полного окисления 1 г питательных веществ;
4) необходимая для полного окисления 1 моль питательных веществ.
38. Функциями состояния термодинамической системы называют такие величины, которые:
1) зависят только от начального и конечного состояния системы;
2) зависят от пути процесса;
3) зависят только от начального состояния системы;
4) зависят только от конечного состояния системы.
39. Процессы, протекающие при постоянной температуре, называются:
1) изобарическими; 2) изотермическими;
3) изохорическими; 4) адиабатическими.
40. Процессы, протекающие при постоянном объеме, называются:
1) изобарическими; 2) изотермическими;
3) изохорическими; 4) адиабатическими.
41. Процессы, протекающие при постоянном давлении, называются:
1) изобарическими; 2) изотермическими;
3) изохорическими; 4) адиабатическими.
41. Внутренняя энергия системы – это:
1) весь запас энергии, кроме потенциальной энергии ее положения и кинетической энергии системы в целом;
2) весь запас энергии системы;
3) весь запас энергии, кроме потенциальной энергии ее положения;
4) величина, характеризующая меру неупорядоченности расположения частиц системы.
42. В изолированной системе самопроизвольно протекает химическая реакция с образованием некоторого количества продукта. Энтропия такой системы:
1) уменьшается; 2) увеличивается; 3) не изменяется; 4) достигает максимального значения.
43. Направленность химического процесса одновременно определяется действующими факторами:
1) энтальпийным и температурным; 2) энтальпийным и энтропийным;
3) энтропийным и температурным; 4) изменением энергии Гиббса и температуры.
44. В изобарно-изотермических условиях максимальная работа, осуществляемая системой:
1) равна убыли энергии Гиббса; 2) больше убыли энергии Гиббса;
3) меньше убыли энергии Гиббса; 4) равна убыли энтальпии.
45. Для обратимых процессов изменение свободной энергии Гиббса….
1) всегда равно нулю; 2) всегда отрицательно; 3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
46. Особенности биохимических процессов: а) подчиняются принципу энергетического сопряжения; б) как правило обратимы; в) сложные; г) только экзэргонические (ΔG < 0); д) большинство необратимо.
1) а, б, в, г; 2) б, в, г; 3) а, б, в; 4) в, д.
47. Экзэргонические реакции протекают в организме самопроизвольно, так как:
1) ΔGреакции > 0; 2) ΔG реакции < 0; 3) ΔGреакции = 0; 4) ΔGреакции ≥ 0.
48. Эндэргонические реакции протекают в организме требуют подвода энергии, так как:
1) ΔGреакции > 0; 2) ΔG реакции < 0; 3) ΔGреакции = 0; 4) ΔGреакции ≥ 0.
49. Реакция 2 H2 + N2 → 2 NH3 проводится при 1100С, так что все реагенты и продукты находятся в газовой фазе. В ходе реакции сохраняется величина:
1) объем; 2) энтропия; 3) энтальпия; 4) масса.
50. При гидролизе любого пептида ΔН < 0, ΔS > 0, самопроизвольно данный процесс протекать…
1) будет, т. к. ΔG > 0; 2) не будет, т.к. ΔG > 0; 3) будет, т.к. ΔG < 0; 4) не будет, т.к. ΔG < 0.
4) Выполнить следующие задания –подготовиться к выполнению лабораторной работы «Определение энтальпии различных химических процессов», целью которой является овладение навыками экспериментального определения энтальпии химических процессов на примере реакции нейтрализации и процессов растворения химических соединений.
Методика проведения работы.
Определение теплоты, выделяемой или поглощаемой при протекании химического процесса, осуществляется с помощью калориметра. Калориметр – устройство, в котором количество теплоты, выделяемой или поглощаемое в ходе процесса, измеряется по изменение температуры калориметра. Калориметр состоит из двух сосудов – внешнего и внутреннего, пространство между которыми представляет воздушную изотермическую оболочку для предотвращения потерь теплоты. Крышка внутреннего сосуда снабжена отверстиями для ручной мешалки, воронки для введения веществ, термометра для измерения температуры.
Опыт 1. Определение энтальпии нейтрализации сильной кислоты щелочью
| Варианты | ||||
| Кислота | HCl | HCl | HNO3 | HNO3 |
| Щелочь | NaOH | KOH | NaOH | KOH |
Уравнение реакции нейтрализации: HCl (p) + NaOH (p) = NaCl (р) + H2O (ж)
Н+ (р) + ОН- (р) = H2O (ж)
Расчет энтальпии нейтрализации сильной кислоты щелочью ведется по кратному ионному уравнению, которое отражает сущность взаимодействия сильных электролитов.
1. Взвесьте внутренний сухой стакан калориметра с точностью до 0,1 г.
2. Налейте в него 25 мл 2н раствора кислоты и измерьте начальную температуру раствора.
3. Быстро прилейте 25 мл 2н раствор щелочи, перемешайте и определите конечную температуру смеси – наивысшую температуру раствора.
4) Результаты представить в виде заполненной таблицы:
| t | t | ∆t | Теплота, пошедшая на нагревание смеси | Теплота, пошедшая на нагревание стакана | |||||
| Vp | ρp | Cp | Q1 | m | C | Q2 | |||
Расчет количество теплоты, которое выделилось при нейтрализации и пошло на нагревании смеси, произвести по формуле: Q1 = Cp ρp Vp ∆t,
где Vp – суммарный объем раствора, мл;
ρp – плотность раствора, для разбавленных растворов принимается равной плотности воды,
т.е. 1 г/мл;
Cp – удельная теплоемкость раствора, равная 3,5 Дж/(г К);
∆t – разность между конечной и начальной температурами.
Расчет количество теплоты, пошедшее на нагревание стакана, произвести по формуле:
Q2 = C m ∆t,
где m – масса стакана, г;
С – удельная теплоемкость стекла, равная 0,838 Дж/(г К).
Расчет экспериментальной энтальпии реакции нейтрализации для одного моль эквивалентов кислоты произвести по формуле:
ΔНнейтр. = -(Q1 + Q2) / nэ [Дж/моль],
где nэ - число моль эквивалентов кислоты, взятое для реакции, которое рассчитывают по формуле: nэ = СHCl VHCl.
(Повышение температуры в калориметре свидетельствует о том, что энтальпия системы уменьшилась).
Сравните полученный результат с рассчитанным теоретическим значением и вычислите относительную ошибку опыта:
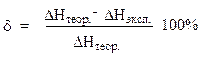
5) В выводе ответьте на следующие вопросы:
а) По изменению температуры опыта укажите, экзо- или эндотермической является реакция нейтрализации сильной кислоты щелочью? Какой знак имеет энтальпия этой реакции?
б) Объясните, почему энтальпия нейтрализации сильной кислоты щелочью не зависит от природы кислоты или щелочи и является величиной постоянной.
Опыт 2. Определении энтальпии растворения вещества
| Варианты | ||
| Соль | КCl | Na2CO3 |
| Навеска, г | 7,45 | 10,60 |
Уравнения физико-химического процесса растворения солей:
KCl (т) + n H2O = K+ (p) + Cl- (p) ΔН растворения (KCl)
Na2CO3 (т) + n H2O = 2 Na+ (p) + CO32- (p) ΔН растворения (Na2CO3)
Теплота растворения твердого вещества в жидкости складывается из тепловых эффектов двух стадий: а) затраты энергии на разрушение кристаллической решетки, ΔН реш. > 0; б) выделения энергии в результате взаимодействия растворяемого вещества с растворителем с образованием сольватной (гидратной) оболочки, ΔН гидр. < 0.
ΔН растворения = ΔН реш. + ΔН гидр.
Суммарная (интегральная) теплота растворения может быть положительной или отрицательной в зависимости от соотношения величин обоих слагаемых. Она равна количеству теплоты, выделившейся или поглощенной при растворении 1 моль веществ в большом объеме растворителя (кДж/моль).
1. В калориметр при помощи мензурки налейте 100 мл дистиллированной воды и измерьте начальную температуру.
2. Высыпьте в калориметр приготовленную навеску безводной соли.
3. непрерывно помешивая раствор мешалкой, наблюдайте за изменениями температуры в течение 6-10 минут с интервалом в 1 минуту.
4. Результаты занесите в таблицу.
| Время начала опыта, мин | |||||||||
| Температура, 0С | tнач |
Определите максимальную температуру tконеч. и вычислите разность температур:
Δt = (tконеч. – tнач.)
Расчет энтальпии растворения 1 моль соли произвести по формуле:
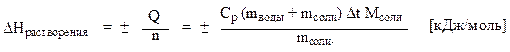
где (mводы + mсоли) – масса раствора, равная сумме масс воды и соли, г;
Ср – удельная теплоемкость раствора, равная 3,8 Дж/ (г К);
Мсоли – молярная масса соли, г/моль;
mсоли – навеска соли, г.
Сравните полученный результат с табличными значениями теплоты растворения солей:
ΔНрастворения (КСl) = + 17,28 кДж/моль ΔНрастворения (Na2CO3) = - 23,60 кДж/моль
Рассчитайте относительную ошибку в процентах. В выводе отметьте причину отклонения экспериментально найденной величины ΔНрастворения от табличного значения; укажите, экзо- или эндотермическим является процесс растворения каждой соли.
Рекомендуемая литература:
Основная:
1. В.А. Попков, С.А. Пузаков. Общая химия: Учебник. - М.: ГЭОТАР-Медиа. - 2010.
2. С.А. Пузаков, В.А. Попков. Сборник задач и упражнений по общей химии. - М.: Высшая школа. – 2004.
Дополнительная:
1. В.И. Слесарев. Основы химии живого.- Санкт-Петербург: Химиздат.- 2001.
2. А.В. Суворов, А.Б. Никольский. Вопросы и задачи по общей химии. – Санкт-Петербург: Химиздат. – 2002.
Методические указания подготовлены: доцентами Н.И. Никитиной и Е.И. Казаковой
Методические указания утверждены на заседании кафедры №_____ от «___» ________20___ г.
Зав. кафедрой: _____________________________/Е.И. Казакова
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 609; Нарушение авторских прав?; Мы поможем в написании вашей работы!