
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физическая химия поверхностных явлений
|
|
|
|
ТЕМА № 10
Книги
Заказы
Продавцы
Покупатели
| Имя поля | Тип | Длина | Индекс |
| Код покупателя | Счетчик | Да | |
| Фамилия | Текстовый | ||
| Имя | Текстовый | ||
| Отчество | Текстовый | ||
| Город | Текстовый | ||
| Адрес | Текстовый | ||
| Страна | Текстовый |
| Имя поля | Тип | Длина | Индекс |
| Код продавца | Счетчик | Да | |
| Фамилия | Текстовый | ||
| Имя | Текстовый | ||
| Отчество | Текстовый | ||
| Должность | Текстовый | ||
| Дата приема | Дата/время | ||
| Оклад | Денежный |
| Имя поля | Тип | Длина | Индекс |
| Код заказа | Счетчик | Да | |
| Код продавца | Числовой | ||
| Код покупателя | Числовой | ||
| Код книги | Числовой | ||
| Дата получения | Дата/время | ||
| Дата отправки | Дата/время | ||
| Количество | Числовой |
| Имя поля | Тип | Длина | Индекс |
| Код книги | Счетчик | Да | |
| Автор | Текстовый | ||
| Название | Текстовый | ||
| Издательство | Текстовый | ||
| Серия | Текстовый | ||
| Год издания | Числовой | ||
| Цена | Денежный |
Приложение 3. Схемы данных БД «Книги»
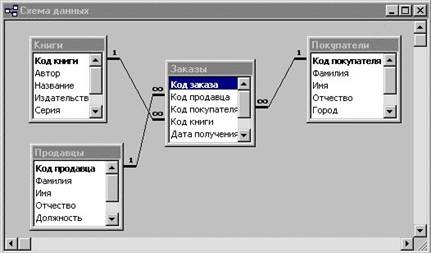
[1] Структура БД «Книги» приведена в приложении 2.
Теоретический материал к занятию:
К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз; они обусловлены особенностями состава и структуры поверхностей.
Образование поверхности раздела фаз требует совершения работы, следовательно, оно сопровождается увеличением свободной энергии системы. В поверхностном слое накапливается некоторый избыток энергии — поверхностная энергия Гиббса Gs, пропорциональная площади поверхности раздела фаз S:
Gs = σS
где σ — коэффициент поверхностного натяжения, т. е. работа образования единицы поверхности. Коэффициент поверхностного натяжения также численно равен силе, приложенной к единице длины контура, ограничивающего поверхность, и направленной вдоль этой поверхности перпендикулярно контуру; dim σ = МТ-2, единица измерения — джоуль на квадратный метр (Дж/м2) или ньютон на метр (Н/м). Следует отметить, что коэффициент поверхностного натяжения часто называют поверхностным натяжением.
Самопроизвольное уменьшение свободной поверхностной энергии Gs в однокомпонентных системах возможно только за счет уменьшения площади поверхности раздела фаз. В многокомпонентных системах уменьшение Gs возможно также за счет уменьшения величины поверхностного натяжения в результате самопроизвольного перераспределения молекул компонента между объемом фазы и поверхностью раздела. Это явление называется адсорбцией.
Границы раздела фаз газ — жидкость и жидкость — жидкость принято называть подвижными, а границы газ — твердое тело, жидкость — твердое тело, твердое тело — твердое тело — неподвижными. Ниже будут рассмотрены адсорбционные процессы в таких системах, в которых жидкость представлена водным раствором.
В зависимости от природы растворенного вещества (компонента) возможно увеличение или уменьшение его концентрации в поверхностном слое.
Положительно адсорбирующиеся вещества уменьшают коэффициент поверхностного натяжения водной фазы, их называют поверхностно-активными веществами (ПАВ).
Молекулы ПАВ имеют характерные черты строения: они дифильны, т. е. содержат гидрофобные и гидрофильные фрагменты, и асимметричны. К ПАВ относятся одноатомные спирты, одноосновные карбоновые кислоты, амины, эфиры и др.
Поверхностно-неактивные вещества (адсорбирующиеся отрицательно) либо не изменяют коэффициент поверхностного натяжения водной фазы, либо незначительно его увеличивают. К ним относится большинство неорганических веществ (кислоты, щелочи, соли).
Количественной мерой адсорбции служит величина адсорбции Г (гамма);dimГ = L-2N, единица измерения — моль на квадратный метр (моль/м2). Связь между величиной адсорбции в интервале концентраций и коэффициентом поверхностного натяжения устанавливает уравнение Гиббса:
сср ds
Г = - ¾ × ¾¾,
RT dc
где Δσ — приращение коэффициента поверхностного натяжения, соответствующее приращению концентрации Δc;
cср — среднее значение концентрации раствора в ин-тервале концентраций.
Для ПАВ при увеличении концентрации (Δс > 0) наблюдается уменьшение коэффициента поверхностного натяжения (Δσ < 0). Величину - (dσ/dc) называют по-верхностной активностью; она характеризует способность вещества изменять величину поверхностного натяжения раствора. В соответствии с правилом Траубе увеличение длины цепи молекул ПАВ в данном гомологическом ряду (карбоновые кислоты, спирты, амины) вызывает увеличение поверхностной активности в 3—3,5 раза при переходе к каждому последующему гомологу.
Величина адсорбции зависит от природы соприкасающихся фаз, природы и концентрации растворенного вещества. С увеличением концентрации ПАВ величина адсорбции сначала резко возрастает, но затем дальнейшее увеличение концентрации ПАВ вызывает незначительное увеличение этой величины и в конце концов величина адсорбции перестает зависеть от концентрации ПАВ
По теории Лэнгмюра предельной адсорбции Гмакс соответствует образование насыщенного (мономолекулярного) адсорбционного слоя, что позволяет рассчитать площадь S поперечного сечения, занимаемую одной молекулой, и ее длину l:
S = ¾¾¾,
ГмаксNA
ГмаксМ
l = ¾¾¾
r
где NA - постоянная Авогадро,
r - плотность растворенного вещества,
М – молярная масса.
Величина адсорбции уменьшается при увеличении температуры, что обусловлено усилением интенсивности теплового движения молекул и разупорядочиванием структуры поверхностного слоя.
Причиной адсорбции на поверхности твердых тел является нескомпенсированность силовых полей молекул, находящихся в зонах деформации регулярно устроенной поверхности. Такие зоны называют активными центрами; адсорбцию, проходящую на них, разделяют на физическую и химическую (хемосорбция). Любая поверхность, даже хорошо отшлифованная, имеет свой микрорельеф — совокупность впадин и выступов. Физическая адсорбция обусловлена межмолекулярным взаимодействием (ван-дер-ваальсовым; в ряде случаев — за счет образования водородных связей) и проходит, как правило, на активных центрах, находящихся во впадинах микрорельефа поверхности. Центры химической адсорбции находятся в основном на выступах микрорельефа; при хемосорбции устанавливаются химические связи между атомами, входящими в состав активного центра, и атомами адсорбирующегося вещества.
Различия между физической адсорбцией и хемосорбцией заключаются в следующем:
1) значения стандартных энтальпий хемосорбции (порядка 80—800 кДж/моль) значительно выше таковых величин физической адсорбции (8—20 кДж/моль), значения стандартных энтальпий хемосорбции близки ΔH° химических реакций;
Классический пример адсорбции на твердом теле — поглощение различных газов активированным углем. Твердое тело, на поверхности которого происходит адсорбция, называют адсорбентом, а само адсорбирующееся вещество — адсорбтивом. Практически процесс поглощения вещества поверхностным слоем часто дополняется поглощением адсорбтива всем объемом твердого тела — абсорбцией, суммарный процесс (адсорбция + абсорбция) называют в таком случае просто сорбцией. Сорбция — обратимый процесс. Удаление сорбированного вещества называют десорбцией.
Количественно адсорбция на подвижной (Г) и неподвижной (a) границах раздела описывается уравнением Ленгмюра:
c
a = aмакс¾¾
a + с
где амакс - величина предельной адсорбции, она достигается при занятии всех активных центров адсорбента; dim a = М-1N, единица измерения - моль/г; a - постоянная величина, равная отношению констант скоростей десорбции и адсорбции, имеющая размерность концентрации.
В некоторых случаях для описания адсорбции используют эмпирическое уравнение Фрейндлиха:
a = Kcn
где n и K - константы, определяемые экспериментально.
Величину адсорбции из раствора на твердом адсорбенте экспериментально определяют по изменению концентрации растворенного вещества после завершения адсорбции, т. е. установления адсорбционного равновесия по формуле:
(co-c)V
a = ———
m
где co и с — исходная и равновесная концентрация раствора соответственно, моль/л;
V - объем раствора, из которого производилась адсорбция, л; m — масса адсорбента, г.
Константы уравнения Ленгмюра определяются экспериментально по графику 1/a = f(1/c).
Величина адсорбции значительно зависит от удельной поверхности адсорбента. Удельная поверхность адсорбента Sуд равна отношению площади его поверхности к объему. Она обратно пропорциональна размеру частиц и зависит от их формы. При дроблении и измельчении твердых тел величина их удельной поверхности увеличивается вплоть до значений, достигающих тысячи квадратных метров на куби-ческий сантиметр твердого тела. Чем больше удельная поверхность адсорбента, тем больше имеется активных центров и, следовательно, больше величина адсорбции.
Величина адсорбции зависит от природы адсорбента и адсорбтива: чем ближе по полярности адсорбент и адсорбтив, тем полнее происходит адсорбция.
При адсорбции из растворов большое значение имеет и полярность растворителя. Наибольшей склонностью к адсорбции обладают вещества с полярностью, промежу-точной между полярностями контактирующих фаз. Из водных растворов ПАВ хорошо адсорбируются неполярными адсорбентами (в том числе активированным углем), а на полярных адсорбентах (карбонаты, алюмосиликаты, оксиды) ПАВ хорошо адсорбируются из неполярных сред. В основе этих явлений лежит конкуренция между молекулами адсорбтива и растворителя за активные центры адсорбента.
В соответствии с правилом Ребиндера адсорбция идет в сторону выравнивания полярностей контактирующих фаз и тем сильнее, чем больше начальная разность полярностей.
Адсорбция из растворов электролитов осложняется ярко выраженным характером электростатических взаимодействий, приводящих к образованию на поверхности адсорбента двойного электрического слоя (ДЭС).
Различают следующие разновидности адсорбции из растворов электролитов:
1) эквивалентную;
2) обменную;
3) избирательную.
При эквивалентной адсорбции катионы и анионы адсорбируются в таких количествах, которые соответствуют нулевому суммарному заряду. Эквивалентную адсорбцию формально можно рассматривать как адсорбцию неэлектролита, так как при этом не возникают отрицательно или положительно заряженные поверхности.
Обменная адсорбция заключается в обмене ионами между адсорбентом и раствором: адсорбенты, способные к обмену катионов, называются катионитами;
анионов — анионитами.
При избирательной адсорбции на поверхности адсорбента накапливаются либо катионы, либо анионы. Ионы противоположного заряда сохраняют при этом относительную подвижность в растворе. Таким образом, в результате избирательной адсорбции возникают заряженные поверхности. В соответствии с правилом Панета — Фаянса из раствора преимущественно адсорбируются ионы, которые входят в состав кристаллической решетки твердой фазы, или им изоморфные. Так, например, из раствора, содержащего хлорид бария и нитрат стронция, на поверхности кристаллов сульфата бария адсорбируются ионы бария (входят в кристаллическую решетку) и ионы стронция (изоморфны ионам бария); поверхность твердой фазы сульфата бария приобретает положительный заряд. Если тот же адсорбент контактирует с раствором сульфата натрия и перманганата калия, то избирательно на его поверхности адсорбируются сульфат-ионы (входят в кристаллическую решетку) и перманганат-ионы (изоморфны сульфат-ионам). Поверхность твердой фазы приобретает отрицательный заряд. Адсорбция ионов зависит от радиуса иона (она тем больше, чем больше радиус иона) и величины его заряда (многозарядные ионы адсорбируются лучше).
До решения задач необходимо:
I. Выучить определения основных понятий:
1) адсорбция, предельная адсорбция;
2) поверхностное натяжение;
3) коэффициент поверхностного натяжения;
4) поверхностно-активные и поверхностно-неактивные вещества;
5) поверхностная активность;
6) адсорбент, адсорбтив;
7) правило выравнивания полярностей Ребиндера.
II. Разобрать следующие вопросы:
1) подвижная и неподвижная поверхность раздела фаз;
2) связь между величиной адсорбции и коэффициентом поверхностного натяжения (уравнение Гиббса);
3) изменение величины поверхностной активности в гомологическом ряду (правило Траубе);
4) связь величины предельной адсорбции с площадью поперечного сечения и осевой длины молекулы;
5) уравнение изотермы адсорбции Ленгмюра.
III. Обратить внимание на:
1) размерность величин адсорбции на подвижной границе фаз и на твердых адсорбентах.
Примеры решения типовых задач
Пример 1
Расчет величины поверхностной активности ПАВ по изменению поверхностного натяжения; расчет величины поверхностной активности гомолога по правилу Траубе, расчет величины адсорбции ПАВ в заданном интервале концентраций.
Поверхностное натяжение водного раствора пентанола с концентрацией 0,030 моль/дм3 равно 55,3 10-3 Н/м при 298 К. Оцените величину адсорбции бутанола из раствора с концентрацией 0,015 моль/дм3 при той же температуре.
Решение. Найдем поверхностную активность пентанола g(С5Н11OН) в интервале концентраций C1 = 0 (т.е. чистый растворитель) - C2= 0,030 моль/дм3:
g(С5Н11OН) = - 
 - коэффициент поверхностного натяжения воды, справочная величина (табл.11.02.).
- коэффициент поверхностного натяжения воды, справочная величина (табл.11.02.).
В соответствии с правилом Траубе поверхностная активность бутанола, предшествующего члена гомологического ряда предельных одноатомных спиртов, будет в тех же условиях примерно в 3,2 раза меньше:
g(С4Н9OН) = 
Поскольку концентрация раствора бутанола равна 0,015 моль/дм3 является серединой интервала, в котором рассчитывалась поверхностная активность, величина адсорбции из этого раствора рассчитывается по уравнению Гиббса:
Г(C4H9OH) = 
g(С5Н11OН) = 
g(С4Н9OН) = 
Г(С4Н9OН) = 
Ответ: величина адсорбции бутанола приблизительно равна 1 10-6 моль/м2.
Пример 2
Расчет длины и площади поперечного сечения молекулы по величине предельной адсорбции.
Площадь поперечного сечения молекулы пальмитиновой кислоты равна 2,1×10-19м2. Определите величину предельной адсорбции пальмитиновой кислоты на границе бензольный раствор-воздух. Вычислите объем раствора, содержащего 4,24 г кислоты в 1 л бензола, требуемый для покрытия монослоем (после испарения бензола) 1,5 м2 водной поверхности.
Решение. Величину предельной адсорбции данного вещества рассчитывают по уравнению:
Гmax = 
Для покрытия площади S монослоем молекул с площадью поперечного сечения S мол требуется S/S мол молекул. Количество вещества, соответствующее этому числу молекул, рассчитывают по соотношению:
n =  : NA
: NA
Молярная концентрация имеющего раствора пальмитиновой кислоты равна:
С(к-ты) = 
Требуемый объем раствора равен: Vp =  /с
/с
Г max =  = 7,9 10-6моль/м2
= 7,9 10-6моль/м2
n =  = 1,19 10-5моль
= 1,19 10-5моль
с (к-ты) =  = 1,66 10-2моль/дм3
= 1,66 10-2моль/дм3
V = 
Ответ: Г max = 7,9 10-6 моль/м2 Vр = 0,715 мл
__________________________________________________________________________________
Пример 3
Расчет величины адсорбции по уравнению Ленгмюра при заданных константах.
Экспериментально установлено, что максимальная величина адсорбции ПАВ (Mr = 60) некоторым адсорбентом составляет 5,0×10-3 моль/г; величина a равна 0,06 моль/дм3. Сколько граммов вещества адсорбировалось из раствора с равновесной концентрацией 0,1 моль/дм3 двумя граммами данного адсорбента?
Решение. По уравнению Ленгмюра рассчитывают величину адсорбции ПАВ:
а = a max 
Количество адсорбированного вещества на адсорбенте массой 2 г будет в 2 раза больше.
Масса адсорбированного вещества будет равна:
m (ПАВ) = n (ПАВ) М(ПАВ)
а =  = 3,1 10-3моль/г
= 3,1 10-3моль/г
n(ПАВ) = 3,1×10-3моль/г 2 г = 6,2 10-3моль
m(ПАВ) = 6,2×10-3моль 60 г/моль = 0,37 г
Ответ: масса адсорбированного вещества равна 0,37 г.
Пример 4
Расчет величины адсорбции на твердом адсорбенте по изменению концентрации адсорбтива.
Раствор уксусной кислоты объемом60 см3 раствора уксусной кислоты с концентрацией 0,1 моль/дм3 взболтали с 2 г адсорбента. После достижения равновесия пробу раствора объемом 10 см3 оттитровали раствором гидроксида натрия с = 0,05 моль/дм3. На титрование затрачено 15,0 см3 титранта. Вычислите величину адсорбции уксусной кислоты.
Решение. Равновесная концентрация уксусной кислоты равна (по результатам титрования):
(СН3СООН) = 
Величину адсорбции рассчитывают по:
а = 
с(СН3СООН) =  = 0,075 моль/см3
= 0,075 моль/см3
а = 
Ответ: а (СН3СООН) = 6,25 10-4моль/г
Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
10.31; 10.35; 10.40; 10.46,10.52; 10.54
Лабораторная работа 9.3
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 2439; Нарушение авторских прав?; Мы поможем в написании вашей работы!