
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Качественные реакции на анионы
|
|
|
|
| Анион | Реактив | Наблюдаемая реакция |
| S042- | Ва2+ | Выпадение белого осадка, нерастворимого в кислотах: Ва2+ + S042- 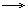 BaS04 BaS04 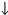
|
| N03- | 1) добавить конц. H2SO4 и Си, нагреть "2) смесь H2S04 +FeSO4 | Образование голубого раствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H20)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») |
| РО43- | ионы Ag+ | Выпадение светло-желтого осадка в нейтральной среде: ЗАg+ + Р043- 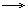 Аg3Р04 Аg3Р04 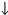
|
| СrO42- | ионы Ва2+ | Выпадоние желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCI: Ва2+ + СrO42- 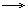 BaCr04 BaCr04 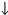
|
| S2-, | ионы РЬ2+ | Выпадение черного осадка: Pb2+ + S2- 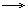 PbS PbS 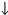
|
| СО32- | ионы Са2+ | выпадение белого осадка, растворимого в кислотах: Са2+ + С032- = СаСОз 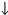
|
| CO2 | известковая вода Са(ОН)2 | Са(ОН)2 + С02 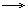 СаСО3 СаСО3 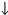 + Н20, СаСО3 + С02 + Н20 + Н20, СаСО3 + С02 + Н20 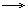 Са(НС03)2 Выпадение белого осадка и его растворение при пропускании С02 Са(НС03)2 Выпадение белого осадка и его растворение при пропускании С02
|
| SO32- | ионы Н+ | Появление характерного запаха S02: 2Н+ + SO32- 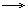 Н20 + S02f Н20 + S02f
|
| F- | ионы Са2+ | Выпадение-белого осадка: Са2+ + 2F" 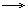 CaF2 CaF2
|
| Cl- | ионы Аg+ | Выпадение белого осадка, не растворимого в HN03, но растворимого в конц. NH3 • Н20: Аg+ +CI- 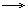 AgCl AgCl  AgCI + 2(NH3• Н20) AgCI + 2(NH3• Н20) 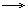 [Ag(NH3)2]+ + CI- + 2Н2О [Ag(NH3)2]+ + CI- + 2Н2О
|
| Br- | ионы Аg+ | Выпадение светло-желтого осадка, не растворимого в HN03: Ag++ Br- = AgBr 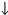 осадок темнеет на свету осадок темнеет на свету
|
| I- | ионы Аg+ | Выпадение желтого осадка, не растворимого в HNO3 и NH3 конц.: Аg+ + I- 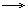 АgI АgI 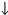 осадок темнеет на свету осадок темнеет на свету
|
| ОН- (щелочная среда) | индикаторы: лакмус фенолфталеин | синее окрашивание малиновое окрашивание |
1. Качественные реакции на катионы.
1.1.1 Качественные реакции на катионы щелочных металлов (Li+, Na+, K+, Rb+, Cs+).
Катионы щелочных металлов возможно провести только с сухими солями, т.к. практически все соли щелочных металлов растворимы. Обнаружить их можно при внесении небольшого количества соли в пламя горелки. Тот или иной катион окрашивает пламя в соответствующий цвет:
Li+ — темно-розовый.
Na+ — желтый.
K+ — фиолетовый.
Rb+ — красный.
Cs+ — голубой.
Катионы так же можно обнаружить и с помощью химических реакций. При сливании раствора соли лития с фосфатами образуется нерастворимый в воде, но растворимый в конц. азотной кислоте, фосфат лития:
3Li+ + PO43- = Li3PO4↓
Li3PO4 + 3HNO3 = 3LiNO3 + H3PO4
Катион K+ можно вывести гидротартрат-анионом HC4H4O6- — анионом винной кислоты:
K+ + HC4H4O6- = KHC4H4O6↓
Катионы K+ и Rb+ можно выявить добавлением к растворам их солей кремнефтористой кислоты H2[SiF6] или ее солей — гексафторсиликатов:
2Me+ + [SiF6]2- = Me2[SiF6]↓ (Me = K, Rb)
Они же и Cs+ осаждаются из растворов при добавлении перхлорат-анионов:
Me+ + ClO4- = MeClO4↓ (Me = K, Rb, Cs).
1.1.2 Качественные реакции на катионы щелочно-земельных металлов (Ca2+, Sr2+, Ba2+, Ra2+).
Катионы щелочно-земельных металлов можно выявить двумя способами: в растворе и по окраске пламени. Кстати, к щелочно-земельным относятся кальций, стронций, барий и радий. Бериллий и магний нельзя отнести к этой группе, как это любят делать на просторах Интернета.
Окраска пламени:
Ca2+ — кирпично-красный.
Sr2+ — карминово-красный.
Ba2+ — желтовато-зеленый.
Ra2+ — темно-красный.
Реакции в растворах. Катионы рассматриваемых металлов имеют общую особенность: их карбонаты и сульфаты нерастворимы. Катион Ca2+ предпочитают выявлять карбонат-анионом CO32-:
Ca2+ + CO32- = CaCO3↓
Который легко растворяется в азотной кислоте с выделением углекислого газа:
2H+ + CO32- = H2O + CO2↑
Катионы Ba2+, Sr2+ и Ra2+ предпочитают выявлять сульфат-анионом с образованием сульфатов, нерастворимых в кислотах:
Sr2+ + SO42- = SrSO4↓
Ba2+ + SO42- = BaSO4↓
Ra2+ + SO42- = RaSO4↓
1.1.3. Качественные реакции на катионы свинца (II) Pb2+, серебра (I) Ag+, ртути (I) Hg2+, ртути (II) Hg2+. Рассмотрим их на примере свинца и серебра.
Эта группу катионов объединяет одна общая особенность: они образуют нерастворимые хлориды. Но катионы свинца и серебра можно выявить и другими галогенидами.
Качественная реакция на катион свинца — образование хлорида свинца (осадок белого цвета), либо образование иодида свинца (осадок ярко желтого цвета):
Pb2+ + 2I- = PbI2↓
Качественная реакция на катион серебра — образование белого творожистого осадка хлорида серебра, желтовато-белого осадка бромида серебра, образование желтого осадка иодида серебра:
Ag+ + Cl- = AgCl↓
Ag+ + Br- = AgBr↓
Ag+ + I- = AgI↓
Как видно из выше изложенных реакций, галогениды серебра (кроме фторида) нерастворимы, а бромид и иодид даже имеют окраску. Но отличительная черта их не в этом. Данные соединения разлагаются под действием света на серебро и соответствующий галоген, что также помогает их идентифицировать. Поэтому часто емкости с этими солями испускают запахи. Также при добавлении к данным осадкам тиосульфата натрия происходит растворение:
AgHal + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaHal, (Hal = Cl, Br, I).
То же самое произойдет при добавлении жидкого аммиака или его конц. раствора. Растворяется только AgCl. AgBr и AgI в аммиаке практически нерастворимы:
AgCl + 2NH3 = [Ag(NH3)2]Cl
Существует также еще одна качественная реакция на катион серебра — образование оксида серебра черного цвета при добавлении щелочи:
2Ag+ + 2OH- = Ag2O↓ + H2O
Это связано с тем, что гидроксид серебра при нормальных условиях не существует и сразу же распадается на оксид и воду.
1.1.4. Качественная реакция на катионы алюминия Al3+, хрома (III) Cr3+, цинка Zn2+, олова (II) Sn2+. Данные катионы объединены образованием нерастворимых оснований, легко переводимых в комплексные соединения. Групповой реагент — щелочь.
Al3+ + 3OH- = Al(OH)3↓ + 3OH- = [Al(OH)6]3-
Cr3+ + 3OH- = Cr(OH)3↓ + 3OH- = [Cr(OH)6]3-
Zn2+ + 2OH- = Zn(OH)2↓ + 2OH- = [Zn(OH)4]2-
Sn2+ + 2OH- = Sn(OH)2↓ + 2OH- = [Sn(OH)4]2-
Не стоит забывать, что основания катионов Al3+, Cr3+ и Sn2+ не переводятся в комплексное соединение гидратом аммиака. Этим пользуются, чтобы полностью осадить катионы. Zn2+ при добавлении конц. раствора аммиака сначала образует Zn(OH)2, а при избытке аммиак способствует растворению осадка:
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2
Раствор, содержащий [Cr(OH)6]3-, при добавлении хлорной или бромной воды в щелочной среде становится желтым из-за образования хромат-аниона CrO42-:
2[Cr(OH)6]3- + 3Br2 + 4OH- = 2CrO42- + 6Br- + 8H2O
1.1.5. Качественная реакция на катионы железа (II) и (III) Fe2+, Fe3+. Данные катионы также образуют нерастворимые основания. Иону Fe2+ отвечает гидроксид железа (II) Fe(OH)2 — осадок белого цвета. На воздухе сразу покрывается зеленым налетом, поэтому чистый Fe(OH)2 получают в атмосфере инертых газов либо азота N2.
Катиону Fe3+ отвечает метагидроксид железа (III) FeO(OH) бурого цвета. Примечание: соединения состава Fe(OH)3 неизвестно (не получено). Но все же большинство придерживаются записи Fe(OH)3.
Качественная реакция на Fe2+:
Fe2+ + 2OH- = Fe(OH)2↓
Fe(OH)2 будучи соединением двухвалентного железа на воздухе неустойчиво и постепенно переходит в гидроксид железа (III):
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Качественная реакция на Fe3+:
Fe3+ + 3OH- = Fe(OH)3↓
Еще одной качественной реакцией на Fe3+ является взаимодействие с роданид-анионом SCN-, при этом образуется роданид железа (III) Fe(SCN)3, окрашивающий раствор в темно-красный цвет (эффект «крови»):
Fe3+ + 3SCN- = Fe(SCN)3
Роданид железа (III) легко «разрушается» при добавлении фторидов щелочных металлов:
6NaF + Fe(SCN)3 = Na3[FeF6] + 3NaSCN
Раствор становится бесцветным.
Очень чувствительная реакция на Fe3+, помогает обнаружить даже очень незначительные следы данного катиона.
1.1.6. Качественная реакция на катион марганца (II) Mn2+. Данная реакция основана на жестком окислении марганца в кислой среде с изменением степени окисления с +2 до +7. При этом раствор окрашивается в темно-фиолетовый цвет из-за появления перманганат-аниона. Рассмотрим на примере нитрата марганца:
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
1.1.7. Качественная реакция на катионы меди (II) Cu2+, кобальта (II) Co2+ и никеля (II) Ni2+. Особенность этих катионов в образовании с молекулами аммиака комплексных солей — аммиакатов:
Cu2+ + 4NH3 = [Cu(NH3)4]2+
Аммиакаты окрашивают растворы в яркие цвета. К примеру, аммиакат меди окрашивает раствор в ярко-синий цвет.
1.1.8. Качественные реакции на катион аммония NH4+. Взаимодействие солей аммония со щелочами при кипячении:
NH4+ + OH- =t= NH3↑ + H2O
При поднесении влажная лакмусовая бумажка окрасится в синий цвет.
1.1.9. Качественная реакция на катион церия (III) Ce3+. Взаимодействие солей церия (III) с щелочным раствором пероксида водорода:
Ce3+ + 3OH- = Ce(OH)3↓
2Ce(OH)3 + 3H2O2 = 2Ce(OH)3(OOH)↓ + 2H2O
Пероксогидроксид церия (IV) имеет красно-бурый цвет.
1.2.1. Качественная реакция на катион висмута (III) Bi3+. Образование ярко-желтого раствора тетраиодовисмутата (III) калия K[BiI4] при действии на раствор, содержащий Bi3+, избытком KI:
Bi(NO3)3 + 4KI = K[BiI4] + 3KNO3
Связано это с тем, что сначала образуется нерастворимый BiI3, который затем связывается с помощью I- в комплекс.
На этом я закончу описание выявления катионов. Теперь рассмотрим качественные реакции на некоторые анионы.
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 2470; Нарушение авторских прав?; Мы поможем в написании вашей работы!