
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет теплового эффекта растворения
|
|
|
|
Ход работы.
Определение энтальпии растворения твёрдого вещества.
Цель. Определить энтальпию растворения твёрдого вещества.
Первый этап. Отмерьте мерным цилиндром 100 мл дистиллированной воды и влейте в реакционный сосуд калориметра. После этого поместить термодатчик в калориметр, включить электронный термометр. На первоначальном этапе набрать 4 точек (в течение 2 минут), проводя измерения через 30 секунд.
Второй этап. Через воронку во внутренний сосуд калориметра засыпьте навеску твёрдого вещества.
Показания температуры на ЖК–дисплее записывать через каждые 10 секунд, при этом необходимо производить постоянное перемешивание раствора. На данном этапе необходимо набрать 10 точек.
Третий этап. По истечении этого времени записывать показания термометра через 30 секунд, набирать 6 точек (в течение 3 минут).
По истечении этого времени опыт считается выполненным.
Прибор выключить.
Во время проведения измерений на ЖК–дисплее высвечивается индикация, в первой строке высвечивается время (мин.), во второй – температура (С0). Показания электронного термометра записывают в таблицу (Таблица 3.2).
Теплота Q, выделяющаяся (или поглощаемого) в ходе реакции, расходуется на нагревание жидкости во внутреннем сосуде калориметра сосуде Qж и на нагрев самого стакана Qст, т.е.
Q= Qж+ Qст.
Количество теплоты, поглощённое стаканом и жидкостью в нём, равны:
Qж= сжmж∆t;
Qст= сстmст∆t,
где сж и сст- удельные теплоёмкости соответственно жидкости и стакана (сст = 0,75 кДж/кг*К, сж =сH  O = 4,185 кДж/кг*К)
O = 4,185 кДж/кг*К)
Q = (сН  ОmH
ОmH  O+cстmст)∆t. (1)
O+cстmст)∆t. (1)
mH  O = V H
O = V H  O * ρ H
O * ρ H  O; (2)
O; (2)
Полученная величина теплового эффекта Q показывает количество тепла, которое выделилось (или поглотилось) при растворении твёрдого вещества массой mв. Количество растворённого вещества (nв) составит
nв= mв /Мв, (3)
Экспериментальное значение количества теплоты, выделившейся в ходе реакции Qнейтр. определяется по формуле
Qраств...= 
 , (4)
, (4)
 где ∆H раств. = - Qраств.
где ∆H раств. = - Qраств.
Уравнение реакции растворения можно представить в виде реакции взаимодействия твёрдого вещества с водой:
Xтв + Н2Ож→ Xр-р +Q,
Где Х – твёрдое вещество.
Тепловой эффект реакции растворения твёрдого вещества ∆Н теор рассчитывается по закону Гесса.
Погрешность (ε) измерений теплового эффекта вычисляется по формуле
ε = (∆Н теор - ∆H нейтр. / ∆Н теор)*100 % (6)
В отчёте:
- приведите экспериментальные данные в таблицу 3.2.
| τ,мин | 0,5 | 1,0 | ||||||||
| t, 0C |
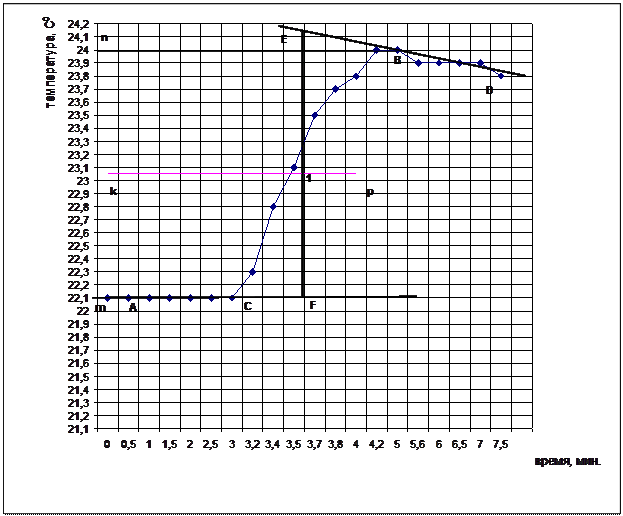
- постройте график зависимости температуры от времени по данным таблицы 3.2.
- по графику определите ∆t;
- запишите объём жидкости в стакане VН2О (мл), массу стакана mст, и массу вещества mв, (кг)
- рассчитайте массу воды m H  O, (кг).
O, (кг).
- рассчитайте количество теплоты Q, выделившейся в ходе реакции, кДж.
- рассчитайте количество вещества nв, моль.
- рассчитайте количество теплоты Qраств., выделившейся в ходе реакции.
– определите тепловой эффект реакции растворения ∆H экспер.
- рассчитайте тепловой эффект реакции растворения ∆H теор.
- определите абсолютную и относительную ошибку эксперимента.
Контрольные вопросы к лабораторной работе «Химическая термодинамика»
1. Гидроксидом калия нейтрализовали 9,8 г серной кислоты и 3,65 г соляной кислоты. Сколько тепла выделилось в каждом случае?
2. Определите возможность самопроизвольного протекания реакции на основании второго закона термодинамики:
2ZnS (т) + 3O2 (г) = 2ZnO (т) + 2SO2(г)
3. Рассчитайте энтальпию химической реакции ΔHo298 х.р.:
4KClO3(к) = KCl(к) + 3KClO4(к)
по следующим данным:
2KClO3(к) = 2KCl(к) + 3O2(г); ΔHo298= -95 кДж/моль;
KClО4(к) = KCl(к)+ 2O2(г); ΔHo298= +9 кДж/моль.
|
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 1195; Нарушение авторских прав?; Мы поможем в написании вашей работы!