
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм мышечного сокращения
|
|
|
|
Мышечное сокращение является сложным механо-химическим процессом, в ходе которого происходит преобразование химической энергии гидролитического расщепления АТФ в механическую работу, совершаемую мышцей.
В настоящее время этот механизм еще полностьюне раскрыт. Но достоверно известно следующее:
Источником энергии, необходимой для мышечной работы является АТФ;
Гидролиз АТФ, сопровождающийся выделением энергии, катализируется миозином, который как уже отмечалось, обладает ферментативной активностью;
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов Са2+ в саркоплазме миоцитов, вызываемое двигательным нервным импульсом;
Во время мышечного сокращения между толстыми и тонкими нитями миофибрилл возникают поперечные мостики или спайки;
Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
Имеется много гипотез, пытающихся объяснить молекулярный механизм мышечного сокращения. Наиболее обоснованной в настоящее время является гипотеза «весельной лодки» или «гребная гипотеза» Х. Хаксли. В упрощенном виде её суть заключается в следующем.
В мышце, находящейся в состоянии покоя, толстые и тонкие нити миофибрилл друг с другом не соединены, так как участки связывания на молекулах актина закрыты молекулами тропомиозина.
Мышечное сокращение происходит под воздействием двигательного нервного импульса, представляющего собою волну повышенной мембранной проницаемости, распространяющуюся по нервному волокну[1]. Эта волна повышенной проницаемости передается через нервно-мышечный синапс на Т-систему саркоплазматической сети и в конечном итоге достигает цистерн, содержащих ионы кальция в большой концентрации. В результате значительного повышения проницаемости стенки цистерн (это тоже мембрана!) ионы кальция выходят из цистерн и их концентрация в саркоплазме за очень короткое время (около 3 мс) возрастает примерно в 1000 раз. Ионы кальция, находясь в высокой концентрации, присоединяются к белку тонких нитей - тропонину и меняют его пространственную форму (конформацию). Изменение конформации тропонина, в свою очередь, приводит к тому, что молекулы тропомиозина смещаются вдоль желобка фибриллярного актина, составляющего основу тонких нитей, и освобождают тот участок актиновых молекул, который предназначен для связывания с миозиновыми головками. В результате этого между миозином и актином (т.е. между толстыми и тонкими нитями) возникает поперечный мостик, расположенный под углом 90 º. Поскольку в толстые и тонкие нити входит большое число молекул миозина и актина (около 300 в каждую), то между мышечными нитями образуется довольно большое количество поперечных мостиков или спаек. На электронной микрофотографии (рис. 15) хорошо видно, что между толстыми и тонкими нитями имеется большое количество поперечно расположенных мостиков.

Рис. 15. Электронная микрофотография продольного среза
участка миофибриллы (увеличение 300000 раз) (Л.Страйнер, 1985)
Образование связи между актином и миозином сопровождается повышением АТФ-азной активности последнего (т.е. актин действует подобно аллостерическим активаторам ферментов), в результате чего происходит гидролиз АТФ:
АТФ + Н2О ¾® АДФ + Н3РО4 + энергия
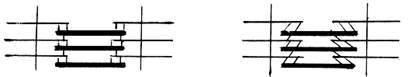 |
За счет энергии, выделяющейся при расщеплении АТФ, миозиновая головка подобно шарниру или веслу лодки поворачивается, и мостик между толстыми и тонкими нитями оказывается под углом 45 º, что приводит к скольжению мышечных нитей навстречу друг другу (рис. 16).
а б
Рис.16. а) образовавшиеся мостики между толстыми и
тонкими нитями располагаются под углом 90º;
б) после поворота мостики оказываются под углом 45º
Совершив поворот, мостики между толстыми и тонкими нитями разрываются. АТФ-азная активность миозина вследствие этого резко снижается и гидролиз АТФ прекращается. Но если двигательный нервный импульс продолжает поступать в мышцу, и в саркоплазме сохраняется высокая концентрация ионов кальция, поперечные мостики вновь образуются, АТФ-азная активность миозина возрастает и снова происходит гидролиз новых порций АТФ, дающий энергию для поворота поперечных мостиков с последующим их разрывом. Это ведет к дальнейшему движению толстых и тонких нитей навстречу друг другу и укорочению миофибрилл и мышечного волокна.
В результате многократного образования, поворота и разрыва мостиков мышца может максимально сократиться, при этом тонкие нити наслаиваются друг на друга (иногда могут переплетаться), а толстые нити упираются в Z-пластинку (при сверхмаксимальном сокращении их концы даже могут быть расплющены) (рис. 17).

Рис. 17. Схема строения участка максимально
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 578; Нарушение авторских прав?; Мы поможем в написании вашей работы!