
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Урок №14
|
|
|
|
А б
Рис. 4. Проекционные формулы Ньюмена конформаций 1,4-бутилциклогексана: а - «кресло», б - «ванна»
Поэтому в «креслах» несвязные взаимодействия также максимальны при a,a -расположении бутильных групп и минимальны при их e,e -расположении.
По увеличению потенциальной энергии конформации 1,4-дибутилциклогексана можно расположить в ряд:
III < II < I << VI < V < IV
Приложение
1. Систематическая номенклатура органических соединений (номенклатура IUPAC).
Первая попытка создания такой номенклатуры была предпринята в Женеве в 1889 г., а, начиная с 1930 г., Международный союз по общей и прикладной химии (IUPAC) совершенствовал и развивал систематическую номенклатуру органических соединений.
Названия первых четырех членов гомологического ряда алканов тривиальные: метан, этан, пропан, бутан. Начиная с пятого, названия образованы от греческих числительных с добавлением суффикса –ан.
Углеводороды разветвленного строения с точки зрения номенклатуры IUPAC представляют собой линейную углеродную цепь, в которой один или несколько атомов водорода замещены углеводородными фрагментами:

Названия по систематической номенклатуре составляют следующим образом:
· В формуле молекулы углеводорода выбирают главную углеродную цепь. Если углеводород – алкан, то главной цепью является самая длинная, если он содержит в своем составе кратные связи или функциональные группы, то главной цепью будет являться самая длинная из тех, что включает их в себя. Все остальные атомы и группы атомов считаются заместителями атомов водорода в главной цепи.

· Затем эту цепь нумеруют с того конца, к которому ближе расположен заместитель (радикал) – атом или группа атомов, в нее не входящих. Если заместителей несколько, то нумерацию проводят так, чтобы сумма цифр, указывающих их положение в цепи, была наименьшей. При наличии в углеводороде кратных связей или функциональных групп, они определяют начало нумерации главной цепи. Названия заместителей перечисляют по алфавиту.
· Углеводород называют в таком порядке: указывают цифрой положение заместителя, потом называют этот заместитель, т.о. перечисляя все заместители в главной цепи, в конце названия добавляют корень, соответствующий числу атомов углерода в главной цепи и суффикс гомологического ряда.
Если в главной цепи содержится несколько одинаковых заместителей, то их объединяют приставкой, соответствующей греческому числительному, которую ставят перед названием этих заместителей. Приставки ди-, три-, тетра- и т.д. не влияют на алфавитное расположение заместителей в названии.
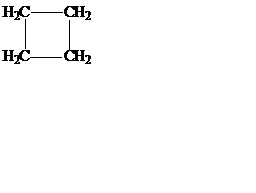
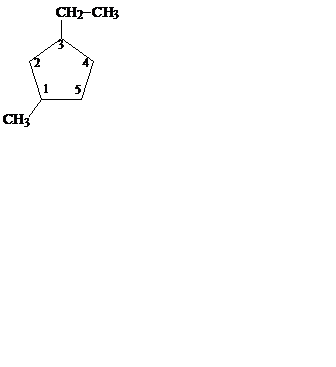
Названия простых циклоалканов по номенклатуре IUPAC образуются путем добавления приставки цикло- к названиям соответствующих алканов. Заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров была минимальной:

| 
| 
|
| метилциклопропан | циклобутан | 1-метил-3-этилциклопентан |
Если в молекуле есть несколько сконденсированных циклических фрагментов, то систематические названия соединений этого типа образуют следующим образом.
Для обозначения типа соединения название начинают с приставки, соответствующей числу сконденсированных циклов (например, бицикло-). Затем в квадратных скобках указывают размер каждого из циклов (цифрами, означающими число атомов углерода в каждой из цепей, которые соединяют атомы углерода, являющиеся общими для всех циклов). В качестве С1 выбирается точка соединения циклов. После этого добавлют корень, соответствующий названию алкана с тем же числом атомов углерода, что и в циклическом соединении.
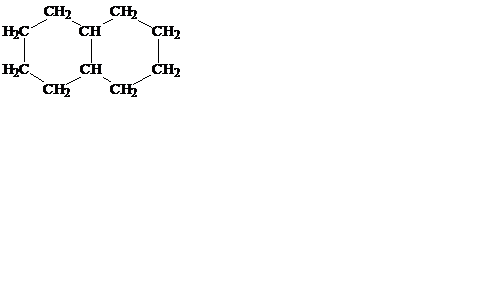
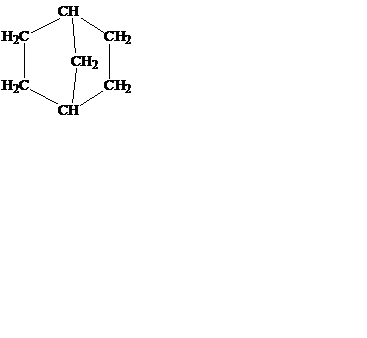
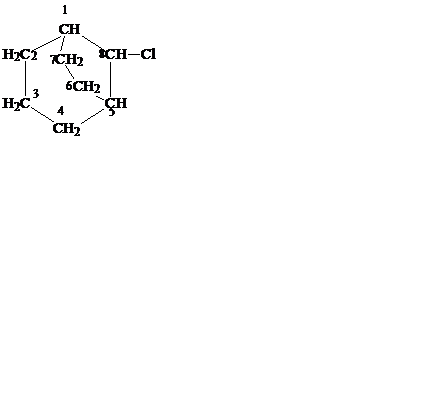
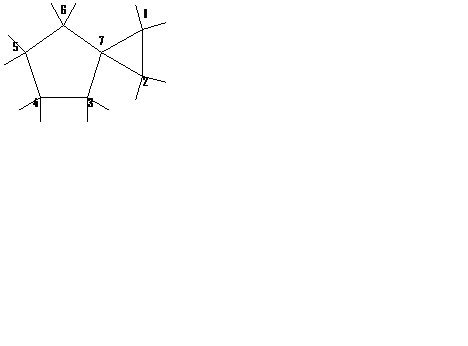
бицикло-[4,4,0]-декан бицикло- 8-хлорбицикло- спиро[2,4]гептан
(декалин) [3,1,1]-гептан -[3,2,1]-октан
Нумерация атомов углерода производится вдоль наиболее длинной цепи между точками соединения циклов от С1 до второй точки соединения, затем продолжается вдоль менее длинной цепи и, наконец, вдоль наиболее короткой линии.
Если два цикла имеют один общий углеродный атом, такие соединения составляют класс спироалканов. Название спироалкана образуют из названия соответствующего алкана, цифрами в квадратных скобках указывают, сколько углеродных атомов находится по каждую сторону от общего (узлового) углеродного атома. Нумерацию атомов углерода в спироалканах начинают всегда с меньшего цикла, а узловой атом нумеруют последним.
2. Рациональная номенклатура углеводородов.
По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода – метана, в молекуле которого один или несколько атомов водорода замещены на алкильные заместители. Эти заместители называют в порядке старшинства (от менее сложных к более сложным). Если заместители одинаковые, их объединяют приставками, аналогично тому же принципу номенклатуры IUPAC. В основе названия лежит слово "метан". В рациональной номенклатуре никогда не используют цифры.
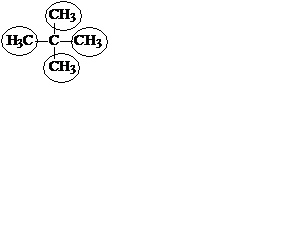
| тетраметилметан (2,2-диметилпропан) | 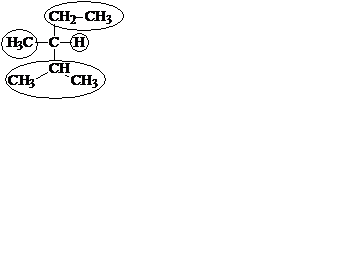
| метилэтилизопропилметан (2,3-диметилпентан) |
По рациональной номенклатуре все алкены называют как производные первого члена гомологического ряда – этилена (принцип аналогичен рациональной номенклатуре алканов), а sp2-гибридные атомы углерода обозначают как a- и b-. Буквой a обозначают наиболее замещенный атом углерода.
В молекуле этилена на простые заместители (радикалы) могут быть замещены четыре атома водорода:
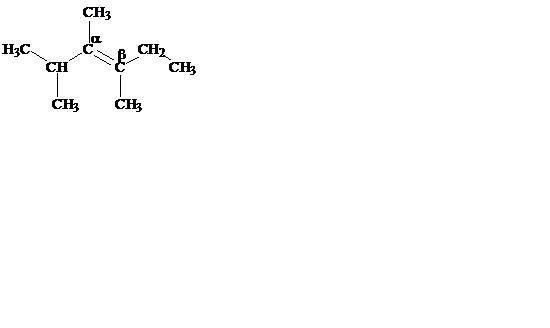

a,b-диметил-a-изопропил-b-этилэтилен триметилэтилен
(2,3,4-триметилгексен-3) (2-метилбутен-2)
Алкины по рациональной номенклатуре называют как производные ацетилена:


диметилацетилен метилэтилацетилен
Таблица I
Брутто-формулы различных гомологических рядов углеводородов
| Общая формула CnH2n+x | Индекс формальной ненасыщен-ностиа) i =(2-x)/2 | Гомологические ряды углеводородов |
| CnH2n+2 | Алканы | |
| CnH2n | Алкены. Циклоалкены | |
| CnH2n-2 | Алкины. Алкадиены. Бициклоалканы. Циклоалкены | |
| CnH2n-4 | Алкатриены. Алкенины. Бициклоалкены. Дициклоалкилэтилены. Трициклоалканы.Циклоалкадиены | |
| CnH2n-6 | Алкадиенины. Алкадиины Алкатетраены.. Бициклоалкадиены. Дициклоалкилаллены.Дициклоалкилацетилены. Тетрациклоалканы. Трициклоалкены.Циклоалкатриены (в том числе арены бензольного ряда) | |
| CnH2n-8 | Алкапентаены. Алкатриенины. Алкендиины. Бициклоалкатриены. Бициклоалкенины.. Пентациклоалканы. Тетрациклоалкены. Трициклоалкины.Циклоалкадиенины. Циклоалкадиины. Фенилалкены. Циклоалкатетраены и др. | |
| CnH2n-10 | Алкагексаены. Алкадиендиины. Алкатетраенины. Алкатриины. Бициклоалкадиенины Бициклоалкадиины.. Бициклоалкатетраены. Гексациклоалканы. Диалкенилбензолы Пентациклоалкены. Тетрациклоалкадиены. Трициклоалкатриены. Трициклоалкенины. Тетрациклоалкины. Фенилалкадиены. Фенилалкины.. Фенилаллены. Циклоалкапентаены и др. |
Окончание табл. I
| Общая формула CnH2n+x | Индекс формальной ненасыщен-ностиа) i =(2-x)/2 | Гомологические ряды углеводородов |
| CnH2n-12 | Алкагептаены. Алкапентаенины. Алкатриендиины. Алкентриины.Циклоалкатриины. Трициклоалкадиины. Бициклопентаены (в том числе арены нафталинового ряда). Трициклоалкатетраены. Тетрациклоалкатриены. Пентациклоалкадиены. Гексациклоалкены. Трициклоалкадиенины. Тетрациклоалкенины. Пентациклоалкины. Гептациклоалкены. Фенилалкенины. Фенилалкатриены. Алкенилалкинилбензолы и др. | |
| CnH2n-14 | Алкагексаенины.. Алкадиентриины. Алкаоктатетраены. Алкатетраендиины. Алкатетраины. Алкенилнафталины. Бициклоалкагексаены. Бициклоалкадиендиины. Бициклоалкатриины. Гексациклоалкадиены. Гексациклоалкины. Гептациклоалкены. Дифенил и его гомологи. Октациклоалканы. Пентациклоалкатриены. Пентациклоалкенины. Тетрациклоалкадиенины. Тетрациклоалкадиины. Тетрациклоалкатетраены. Трициклоалкапентаены. Трициклоалкатриенины. Трициклоалкендиины. Фенилалкадиенины. Фенилалкатетраены. Циклоалкагептаены.Циклоалкентриины и др. |
а) Примечание: величина i равна сумме: число колец в молекуле углеводорода + число формальных p-связей.
Таблица II
Одновалентные углеводородные заместители
| № | Эмпири-ческая формула | Структурная формула | Название | Примечание |
| CH3 | 
| Метил | ||
| C2H | 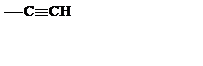
| Этинил | ||
| C2H3 | 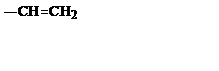
| Винил | ||
| C2H5 | 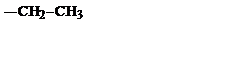
| Этил | ||
| C3H3 | 
| 1-пропинил | ||
| C3H3 | 
| 2-пропинил | ||
| C3H5 | 
| Аллил | ||
| C3H5 | 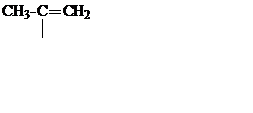
| Изопропенил | ||
| C3H5 | 
| 1-пропенил | ||
| C3H5 | 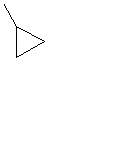
| Циклопропил | ||
| C3H7 | 
| н -пропил | ||
| C3H7 | 
| Изопропил | ||
| C4H7 | 
| 1-бутенил | ||
| C4H7 | 
| 2-бутенил | ||
| C4H7 | 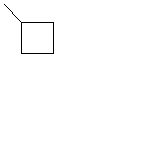
| Циклобутил | ||
| C4H9 | 
| Бутил | ||
| C4H9 | 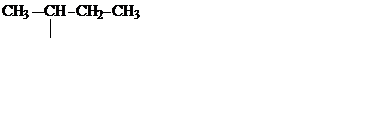
| Вторичный бутил (втор.бутил) | ||
| C4H9 | 
| Изобутил | ||
| C4H9 | 
| Третичный бутил (трет.бутил) | ||
| С5H5 | 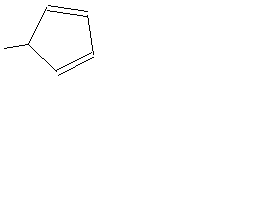
| Циклопентадиенил | Показан 2,4-изомер |
Продолжение табл. II
| № | Эмпири-ческая формула | Структурная формула | Название | Примечание |
| C5H7 | 
| Циклопентенил | Показан 2-изомер | |
| C5H9 | 
| Циклопентил | ||
| C5H11 | 
| Пентил | ||
| C5H11 | 
| Изопентил | ||
| C5H11 | 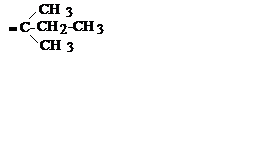
| Трет. пентил | ||
| C6H5 | 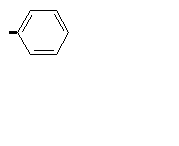
| Фенил | ||
| C6H7 | 
| Циклогексадиенил | Показан 2,5-изомер | |
| C6H9 | 
| Циклогексенил | Показан 3-изомер | |
| C6H11 | 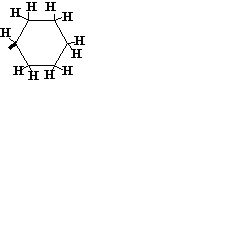
| Циклогексил | ||
| C6H13 | 
| Гексил | ||
| C6H13 | 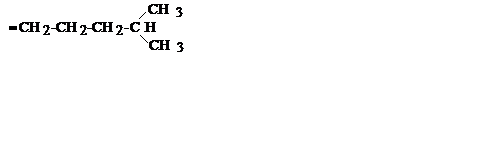
| Изогексил | ||
| C7H7 | 
| Бензил | ||
| C7H7 | 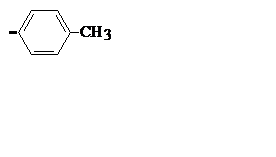
| Толил | Показан 4- или п-изомер | |
| C8H7 | 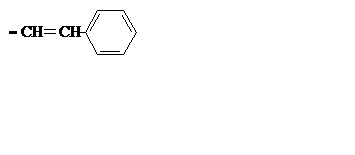
| Стирил | ||
| C8H9 | 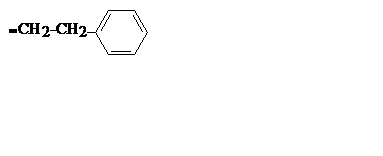
| Фенэтил |
Окончание таблицы II
| № | Эмпири-ческая формула | Структурная формула | Название | Примечание |
| C8H9 | 
| a-метилбензил | ||
| C9H11 | 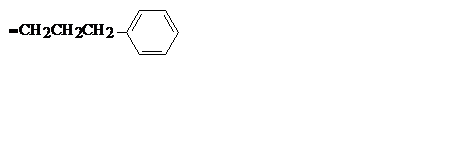
| 3-фенилпропил | ||
| C10H7 | 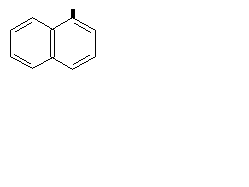
| Нафтил | Показан 1- или a-изомер |
Таблица III
Двух- и трехвалентные углеводородные заместители
| № | Эмпири-ческая формула | Структурная формула | Название | Примечание | |
| CH | 
| Метилидин | |||
| CH2 | 
| Метилен | |||
| C2 | 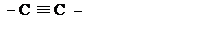
| Этинилен | |||
| C2H2 | 
| Винилен | |||
| C2H2 | 
| Винилиден | |||
| C2H3 | 
| Этилидин | |||
| C2H4 | 
| Этилен | |||
| C2H4 | 
| Этилиден | |||
| C3H4 | 
| Аллилиден | |||
| C3H4 | 
| Пропенилен | |||
| C3H5 | 
| Пропилидин | |||
| C3H6 | 
| Пропилен | |||
| C3H6 | 
| Пропилиден | |||
| C3H6 | 
| Изопропилиден | |||
| C3H6 | 
| Триметилен | |||
| C4H6 | 
| 2-Бутенилен | |||
| C4H7 | 
| Бутилидин | |||
| C4H7 | 
| Изобутилидин | |||
| C4H8 | 
| Бутилиден | |||
| C4H8 | 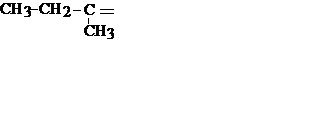
| Втор. бутилиден | |||
| C4H8 | 
| Изобутилиден | |||
| C4H8 | 
| Тетраметилен | |||
| C5H8 | 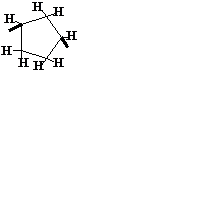
| Циклопентилен | Показан 1,3-изомер | ||
| C5H8 | 
| Циклопентилиден | |||
| C5H9 | 
| Изопентилидин | |||
| C5H9 | 
| Пентилидин | |||
| C5H10 | 
| Пентаметилен | |||
| C5H10 | 
| Пентилиден | |||
| C5H10 | 
| Изопентилиден | |||
| C6H4 | 
| Фенилен | Показан 1,4- или п-изомер | ||
Окончание таблицы III
| C6H10 | 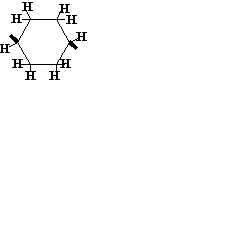
| Циклогексилен | Показан 1,4-изомер | |
| C6H12 | 
| Гексилиден | ||
| C6H12 | 
| Изогексилиден | ||
| C6H12 | 
| Гексаметилен | ||
| C7H5 | 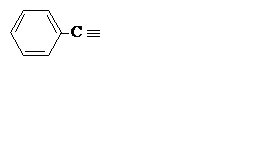
| Бензилидин | ||
| C7H6 | 
| Бензилиден | ||
| C10H6 | 
| Нафтилен | Показан 1,5-изомер |
Таблица IV
Энергии диссоциации и длины связей углерод-углерод в молекулах углеводородов
| № | Тип связи | Тип соединения | Энергия, кДж /моль | Длина, нм |
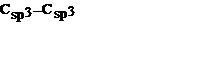
| Алканы и циклоалканы | 0,154 | ||
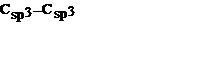
| Циклоалканы с малыми циклами (С3, С4) | »320 | 0,153 | |

| Гомологи этилена, циклоалкены | 0,153 | ||

| Гомологи ацетилена, циклоалкины | 0,147 | ||
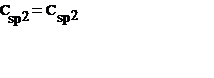
| Этилен, изолировнные алкены | 0,133 | ||
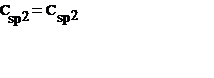
| Формальные двойные связи в сопряженных диенах | 0,135 | ||

| Формальные простые связи в сопряженных диенах | 0,146 | ||

| В бензольных кольцах аренов | 0,140 | ||
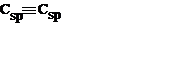
| Ацетилен, изолированные алкины | 0,121 |
Таблица V
Энергии диссоциации и длины связей углерод-водород в молекулах углеводородов
| № | Тип связи | Тип соединения | Энергия, кДж /моль | Длина, нм |
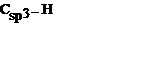
| В метане | 0,112 | ||
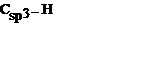
| С первичным атомом углерода | 0,112 | ||
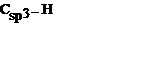
| С вторичным атомом углерода | 0,112 | ||
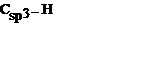
| С третичным атомом углерода | 0,112 | ||
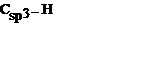
| С атомом углерода в аллильном положении | 0,112 | ||
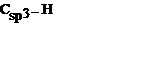
| С атомом углерода в бензильном положении | 0,112 | ||
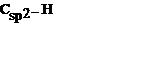
| В алкенах | 0,109 | ||
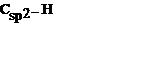
| В ароматическом кольце | 0,110 | ||
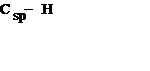
| В алкинах | 0.106 |
Список литературы
1. Реутов, О.А. Органическая химия / О.А. Реутов, А.Л. Курц, К.П. Бутин; – М.: Изд-во МГУ, 1999. Т. 1. 560с., Т. 2. 624с.
2. Реутов, О.А. Органическая химия / О.А. Реутов, А.Л. Курц, К.П. Бутин; – М.: БИНОМ. Лаборатория знаний, 2004. Т. 3., 544с. Т. 4. 726с.
3. Грандберг, И.И. Органическая химия: учебник для бакалавров / И.И. Грандберг, Н.Л. Нам. - М.: Юрайт, 2013. - 608 c.
4. Шабаров, Ю.С. Органическая химия / Ю.С. Шабаров. – СПб.; Лань, 2011, 848с.
5. Березин, Б.Д. Органическая химия / Б.Д. Березин, Д.Б. Березин. – М.: Юрайт, 2012, 768с.
6. Нейланд, О.Я. Органическая химия / О.Я. Нейланд. – М.: Высш. шк, 1990, 752.
7. Травень В.Ф. Органическая химия / В.Ф. Травень. – М.: Академкнига, 2004. Т. 1. 727с., Т. 2. 582с.
8. Несмеянов, А.Н. Начала органической химии / А.Н. Несмеянов, Н.А. Несмеянов. – М.: Химия, 1974. Т. 1. 664с., Т. 2. 824с.
9. Моррисон, Р. Органическая химия / Р. Моррисон, Р. Бойд. – М.: Мир, 1974. - 1132с.
10. Петров, А. А. Органическая химия: учебник для вузов / А. А. Петров,
X. В. Бальян, А. Т. Трощенко. – СПб.; Иван Федоров, 2002. 624с.
11. Днепровский, А.С. Теоретические основы органической химии / А.С. Днепровский, Т.И. Темникова. – Л: Химия, 1991. 560с.
Составители:
Шухто Ольга Владимировна
Андрианов Владимир Геннадьевич
Строение, номенклатура, природа химических связей в молекулах углеводородов
Методические указания
Редактор В.Л. Родичева
Подписано в печать 13.02.2014. Формат 60х84 1/16. Бумага писчая. Усл. печ. л. 2,79. Уч-изд. л. 3,10. Тираж 100 экз. Заказ
Ивановский государственный химико-технологический университет
Отпечатано на полиграфическом оборудовании кафедры экономики и финансов ИГХТУ
153000, г. Иваново, Шереметевский пр., 7
* Было бы точнее учитывать различия в свободных энергиях активации DG¹ процессов образования радикалов: DG¹ = DH¹ - TDS ¹, где DH¹ - энтальпия активации, равная приблизительно энергии активации Еакт, а DS ¹ - энтропия активации. Однако опыт показывает, что в случае сравнительно простых радикалов некоторые различия в энтропийных составляющих не отражаются существенно на том порядке изменения легкости образования радикалов, который может быть предсказан на основании различий энтальпий (т.е. энергий) активации.
Тема: «Цветные металлы, сплавы, область применения»
Цель: ознакомиться с цветными металлами и сплавами, их свойствами и областью применения.
Изучить теоретический материал на стр.55-57 (учебник Н.И.Макиенко «Основы материаловедения», Высшая школа, М., 1986).
Домашнее задание: ответить на вопросы на стр.57.
Предмет: «Материаловедение»
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2759; Нарушение авторских прав?; Мы поможем в написании вашей работы!