
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
БТШ70: структура и основные функции
|
|
|
|
Суть клеточной реакции на тепловой шок состоит в том, что на стрессирующее воздействие клетка отвечает прекращением синтеза клеточных белков и начинает синтезировать строго ограниченный набор белковых молекул, которые были названы белками теплового шока (БТШ).
Своим открытием белки теплового шока обязаны итальянскому ученому Ферруччо Ритосса.
В 1962 г. помещая личинок Drosophila busckii в условия повышенной температуры, итальянский профессор Ферруччо Ритосса впервые обнаружил индукцию экспрессии БТШ, сопровождающуюся образованием 9 добавочных пуфов на политенных хромосомах (рис. 5). Политенными называют гигантские хромосомы, образованные стопками параллельно упакованных гомологичных нитей хроматина, которых может быть больше 1000. Пуф – вздутие на самой хромосоме, образующееся за счет разрыхления структуры хроматина в активном гене и накопления синтезирующихся молекул РНК (рис. 6). Впоследствии было показано, что пуффинг является видимым отражением активации транскрипции генов БТШ. Так же деформация политенных хромосом возникала в ответ на обработку клеток ферментными ядами, блокирующими окислительное фосфорилирование (Жимулев, 2003).

Рис. 5. Ферруччо Ритосса в своей лаборатории в начале 1960-х годов (по: De Maio, 2012).

Рис. 6. Динамика образования пуфа: а — нефункционирующая (спирализованная) хромосома, видна ее дискоидальная структура; б — начальное развитие пуфа, слабая деспирализация хромосомы, видны хромонемные нити; в — максимально развитый пуф, сильная деспирализация (по: Жимулев, 2003).
Исследование БТШ происходило не только на дрозофиле. Пресноводная гидра Hydra oligactus неспособна синтезировать БТШ и погибает при незначительном прогревании. Близкий вид Hydra attenuata имеет нормальный синтез БТШ и выживает при таком же температурном воздействии (Bosch et al., 1988). Дальнейшие исследования показали, что синтез БТШ в ответ на тепловой стресс идентифицирован у широкого спектра организмов — от бактерии до человека (Schlesinger et al., 1982). Подтверждением защиты клетки БТШ от повреждений, вызванных гипертермией, является то, что организмы, не синтезирующие БТШ в ответ на тепловой шок, крайне термочувствительны. У ранних эмбрионов Drosophila melanogaster не происходит синтеза БТШ при действии ТШ (Dura, 1981; Foe, Alberts, 1985), поэтому период раннего эмбриогенеза D. melanogaster является удобной естественной моделью для изучения последствий действия ТШ в отсутствии синтеза БТШ.
|
|
|
БТШ индуцируются не только на действие высоких температур, но и при разнообразных стрессорных воздействиях на организм. Например, помимо непосредственного участия всех БТШ в защите клеточных белков от разных видов денатурации и окисления, БТШ с помощью различных еще до конца не изученных механизмов участвуют в защите клеток от стресс-индуцируемого апоптоза, блокируя пути его активации и стабилизируя клеточные структуры. Подобный ответ на стрессорные воздействия был обнаружен у самых разных организмов, как эукариот, так и прокариот (Tanguay, 1988).
В клетке синтезируется несколько фракций БТШ с различными молекулярными массами (Feder, Hofmann, 1999). Фракции БТШ разных организмов, приблизительно соответствуют друг другу по молекулярной массе. Общепринятой стала классификация, основанная на разделении БТШ по молекулярным массам на несколько семейств (Lindquist, 1986):
1) семейство малых или низкомолекулярных БТШ (нмБТШ) с молекулярными массами от 10 до 30 кДа; (низкомолекулярные БТШ (нмБТШ) массой 10 - 30 кДа) наименее консервативны в эволюции и проявляют видовую специфичность (Vos et al., 2008). Гены малых БТШ имеют бимодальную экспрессию. С одной стороны, они координированно активируются ТШ, с другой стороны, независимо экспрессируются на разных стадиях развития (Mason et al., 1984).
|
|
|
2) группа высокомолекулярных БТШ, ее основные семейства:
- БТШ40 (40 кДа); относится к группе J-белков, гомологичных белку DnaJ E. сoli (Hartl, Hayer-Hartl, 2002). DnaJ – белок с молекулярной массой 41 кДа. Он обладает шаперонной активностью (может связываться с белками, лишенными нативной конформации, и предотвращать их агрегацию), а также является кошапероном БТШ70. У человека найдено несколько десятков представителей семейства J-белков (Fan et al., 2003).
- БТШ60 (белки с молекулярными массами 58, 60 кДа); необычное семейство стрессовых белков, выделяемое в особую группу шаперонинов. К ним относятся бактериальный GroEL, митохондриальный БТШ60, эукариотический цитозольный ССТ (Chaperonin Containing ТСР-1 (ТСР-1 - tailless complex polypeptide-1)), также называемый TRiC, и БТШ60 архебактерий. ССТ не требует белковых кофакторов для функционирования. GroEL и БТШ60 нуждаются в кофакторах – GroES или БТШ10.
- БТШ70 (белки с молекулярными массами 68, 70, 72, 73 кДа, кодируемые индуцибельными генами теплового шока);
- белки с молекулярными массами 70 и 73 кДа, кодируемые когнатными генами ТШ – hsc70, hsc73;
- белки, синтезируемые при истощении клеточного пула глюкозы – глюкозо-регулируемые белки (GRP, glucose regulated proteins) c молекулярными массами 75, 78, 80 кДа);
- БТШ90 (белки с молекулярными массами 83, 87, 89 кДа); конститутивно синтезируемые белки, хорошо представленные в пуле клеточных белков. При ТШ и других стрессовых воздействиях их синтез возрастает. БТШ90 находятся в комплексе с протеинкиназами и рецепторами стероидных гормонов, выполняя функцию их стабилизации (Wang et al., 2014). В норме БТШ90 – цитоплазматические белки, однако незначительная их часть присутствует и в ядре. БТШ90 находится в димерной форме. Каждый мономер состоит из трех доменов: N-терминального домена (Freeman, Yamamoto, 2002), который осуществляет связывание нуклеотидов; среднего домена, необходимого для гидролиза АТФ и С-терминального домена (Harris et al., 2004), необходимого для димеризации. В каждом из доменов имеются гидрофобные элементы, участвующие в формировании центральной борозды и необходимые для узнавания белка-партнера (Shiau et al., 2006).
- БТШ100 (белки с молекулярными массами более 100 кДа – БТШ101, БТШ104, БТШ110). относятся эукариотические БТШ104, БТШ110 и Grp150, а также прокариотические белки Clp. В присутствии АТФ БТШ100/Clp способны образовывать кольцевые гексамеры, в некоторых случаях (БТШ104) – с наличием внутренней поры (Mayer, 2010). Такие структуры напоминают шаперонины GroEL, однако их поры имеют меньшие размеры (2,5 нм против 4,5 нм у GroEL). Прокариотические белки Clp функционируют как молекулярные шапероны в комплексе с протеазой, подготавливая субстраты к протеолизу путём диссоциации четвертичных и третичных структур по АТФ-зависимому механизму (Zolkiewsky et al., 2012). БТШ100 эукариот играет важную роль в адаптации клетки к экстремальным условиям, необходимы для реактивации аппарата сплайсинга, чувствительного к повышению температуры (Lindquist, Kim, 1996). У Drosophila БТШ100 не были обнаружены, и, скорее всего, их функции выполняют БТШ83 и БТШ70 (Schirmer et al., 1996).
|
|
|
Отформатируйте это как-то. Поставьте а, б или абзац отбейте, а то все слилось воедино.
У некоторых организмов может отсутствовать одна из групп. У дрозофилы выделяют только три семейства БТШ: 1) низкомолекулярные БТШ22, 23, 26 и 27; 2) БТШ70 и 68; 3) высокомолекулярный БТШ83, но не обнаружены БТШ100, их функции выполняют БТШ другой группы (Войников, Иванова, 1988).
Семейство БТШ70– наиболее изученное и многочисленное семейство БТШ, занимающее центральное место в защите клетки в условиях стресса. Белки семейства БТШ70 (68 - 73 кДа) наиболее консервативны в эволюции и имеют сходную структуру у разных организмов (Margulis et al., 1989). Они содержат, по крайней мере, три домена, один из которых отвечает за связывание АТФ, второй - за связывание полипептидных цепей, третий - за связывание кальмодулина (Stevenson, Calderwood, 1990; Wang et al., 1993).
Конститутивные белки этого семейства функционируют в цитозоле, эндоплазматическом ретикулуме (ЭПР), митохондриях и ядре. Индуцибельные белки семейства БТШ70 сразу после ТШ в основном локализуются в ядре, связываясь с хроматином (Velazques et al., 1980) и концентрируясь в районе ядрышка (Pelham, 1984). Небольшая часть остается в цитоплазме, концентрируясь возле мембран. В ходе восстановления после ТШ эти белки перемещаются в цитоплазму (Arrigo et al., 1980).
|
|
|
В геноме D. melanogaster имеются 5 – 6 копий гена, кодирующего стресс-индуцибельный БТШ70, один ген стресс-индуцибельного белка БТШ68 и 7 когнатных генов, чьи продукты выполняют различные функции в клетке при нормальных условиях.
Белки семейства БТШ70 относятся к молекулярным шаперонам, которые представляют собой обширную группу клеточных белков, при нормальных условиях обеспечивающих разворачивание и транспорт полипептидных цепей через мембраны, а также укладку вновь синтезированных полипептидов в третичную и четвертичную структуры (Saibil, 2013). БТШ70 выполняет функции, свойственные молекулярным шаперонам: участвует в сборке вновь синтезированных белков; переносит белки через мембраны органелл; участвует в разборке олигомерных белковых структур и протеолитической деградации нестабильных белков; контролирует биологическую активность регуляторных белков, включая транскрипционные факторы (Mayer, 2013).
БТШ70 связывается с денатурированными белками, предотвращает их дальнейшую агрегацию и возвращает к нативному состоянию, используя энергию АТФ и помощь белков-кошаперонов (Nollen, Morimoto, 2002). Связываясь с денатурированными белками, БТШ70 поддерживают их в частично "раскрученном" виде (Hartl, Haer-Hartl, 2002). Способность этого семейства белков узнавать несвернутые пептиды связана с особенностями их строения: пептид-связывающий сайт БТШ70 содержит полость, в которой происходит связывание полипептида. БТШ70 узнает линейные полипептидные последовательности, богатые гидрофобными аминокислотами, которые локализуются внутри нормально свернутого белка, и, следовательно, расположение таких повторов на поверхности белка является признаком неправильной конформации. Взаимодействие с БТШ70 приводит к стабилизации белка-субстрата в развернутом виде, что предотвращает агрегацию (рис. 7). Далее либо сразу происходит правильное сворачивание белка, либо субстрат переносится на другой тип шаперонов для дальнейшего восстановления нативной конформации. На каждом этапе сворачивания белка происходит гидролиз АТФ с участием J-белка (Kampinga, Craig, 2010). Диссоциация АДФ стимулируется белками Hip (HSP70-interacting protein) и р60 или Hop (HSC70/HSP90-organizing protein). Связывание БТШ70 с АТФ и субстратом стимулируется белком Hap (HSP70- and HSC70-associating protein) (Gebauer et al., 1998). Для достижения правильной конформации белка требуется несколько таких циклов.
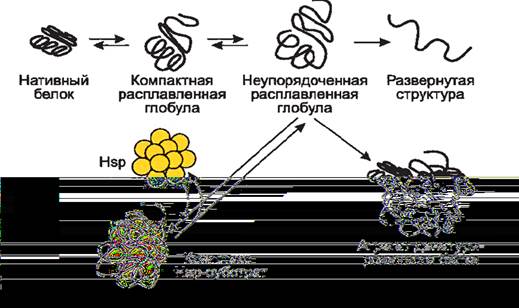
Рис. 7. Механизм действия БТШ (по Lindner R.A. et al., 2001).
Рисунок какой-то битый, половина не видна.
Помимо защиты клетки от стресса, шапероны выполняют важные функции в нормальных условиях. БТШ70 необходимы для фолдинга вновь синтезируемых белков при отделении их от рибосомы (Nelson et al., 1992). Шапероны важны для транспорта белков в ЭР и митохондрии. В цитозоле белки связаны с БТШ72/73; при транспорте клеточных белков через мембрану они освобождаются от БТШ, причём этот процесс требует гидролиза АТФ. БТШ72/73 поддерживают полипептидную цепь в развёрнутом состоянии, препятствуя образованию третичной структуры, что необходимо для её прохождения через трансмембранную пору. После прохождения через мембрану и отщепления N-концевой сигнальной последовательности полипептидная цепь связывается с БТШ70 матрикса, от которого затем также освобождается с гидролизом АТФ, и с БТШ60, который обусловливает правильный фолдинг и/или олигомеризацию транспортируемых белков (Neupert et al., 1990).
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1340; Нарушение авторских прав?; Мы поможем в написании вашей работы!