
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая связь
|
|
|
|
Химическая связь - состояние взаимодействующих атомов, обусловленное перекрыванием электронных облаков их валентных электронов и сопровождающееся уменьшением полной энергии системы.
Химическая связь удерживает атомы или группы атомов друг около друга. Строение и свойства молекул или других частиц ха-рактеризуются рядом параметров химической связи – энергией связи, длиной связи (межатомные расстояния), валентным углом (угол между воображаемыми прямыми, проходящими через ядра атомов).
Количество энергии, выделяющееся при образовании химической связи, называется энергий связи и измеряется в кДж/моль.
Энергия связи является мерой ее прочности: чем выше энергия связи, тем прочнее молекула.
Различают несколько видов химической связи:
· ковалентную (полярную и неполярную),
· ионную,
· металлическую,
· водородную.
Ковалентная связь - это связь, возникающая за счет перекрывания электронных облаков взаимодействующих атомов (образования общих электронных пар возникающих при объединении валентных электронов разных атомов).
Количество электронов, которое атом может использовать для образования химических связей, определяется валентностью элемента. Номер группы, в которой находится элемент, обычно совпадает с максимальным количеством валентных электронов. Исключение - азот, кислород, фтор, гелий, неон.
У элементов главных подгрупп все валентные электроны расположены на внешнем энергетическом уровне. У элементов побочных подгрупп валентные электроны расположены на внешнем и частично на предвнешнем энергетическом уровнях.
Существуют два механизма образования ковалентной связи – обычный (обменный) механизм и донорно-акцепторный механизм.
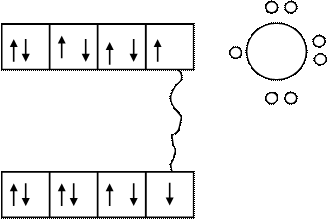
Обычный механизм образования ковалентной связи заключается в том, что по одному неспаренному электрону двух разных атомов образуют общее электронное облако, которое окружает ядра обоих атомов. Эти электроны должны иметь различное значение квантовых чисел.
Графически это можно представить по-разному.
1) с помощью записи внешних электронов в виде точек, окружающих химический знак элемента (так называемая электронно-точечная формула).
Например, молекула хлора Cl2 образуется из двух атомов хлора, имеющих следующее строение электронных оболочек:
 |
17Сl (1 s 22 s 22 p 6 3 s 23 p 5)
 |
17Сl (1 s 22 s 22 p 6 3 s 23 p 5)
В результате обобществления валентных электронов, каждый из атомов получает устойчивую восьмиэлектронную оболочку:
 Общая
Общая

 электронная
электронная
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 559; Нарушение авторских прав?; Мы поможем в написании вашей работы!