
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кристаллические решетки твердых тел
|
|
|
|
Твердые тела могут быть кристаллическими и аморфными.
Кристаллическими называются твердые тела, для которых характерно строго упорядоченное расположение частиц, приводящее к образованию периодически повторяющейся в пространстве структуры – кристаллической решетки. В отличие от них, аморфные твердые тела не имеют такого расположения частиц.
Свойства твердых кристаллических веществ во многом зависят от характера связи между образующими его кристаллическую решетку частицами – атомами, молекулами, ионами. В зависимости от вида частиц, образующих кристаллическую решетку твердого тела, различают кристаллы с молекулярной, атомной, ионной и металлической структурой.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллической решетки могут служить алмаз, кристаллический бор, кремний и германий, а также сложные вещества, например, такие, в состав которых входит оксид кремния: кремнезем, кварц, горный хрусталь и др.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления, они прочны и тверды, практически нерастворимы.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными, и неполярными. Примерами веществ с молекулярными кристаллическими решетками могут быть все вещества, которые при нормальных условиях находятся в газообразном состоянии, а при низких температурах – твердыми: вода Н2О (лед), оксид углерода (IV) СО2 (сухой лед), хлороводород, сероводород, твердые простые вещества, образованные одно - (благородные газы), двух - (Н2, О2 , Cl2, N2, I2), трех - (О3), четырех - (Р4), восьмиатомными (S8) молекулами.
Большинство твердых органических соединений (исключая соли карбоновых кислот) имеют молекулярные кристаллические решетки.
Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, высокую летучесть. Молекулярные вещества с малым размером молекул плавятся и кипят при более низких температурах, чем вещества с большими молеку-лами.
Следует иметь в виду, что реакционная способность веществ с молекулярными кристаллическими решетками зависит не от прочности кристаллической решетки, а от прочности ковалентных связей внутри молекулы.
В узлах ионных кристаллических решеток находятся катионы металлов и анионы неметаллов или сложные анионы, например, гидроксид – ион ОН–. Связь между ионами имеет ионный характер. Примерами соединений с ионными кристаллическими решетками являются оксиды металлов, основания, соли. В этих кристаллах нельзя выделить отдельные молекулы, и весь кристалл рассматривается как одна гигантская молекула.
По прочности ионные кристаллические решетки уступают атомным, но превосходят молекулярные. Им свойственны сравнительно высокие температуры плавления, малая летучесть, большая твердость. Соединения с ионными кристаллическими решетками обычно хорошо растворимы в воде.
Металлическая кристаллическая решетка характерна для металлов.
В металлах существует особый вид химической связи между атомами в кристаллической решетке, называемый металлической связью (рис. 4.27).
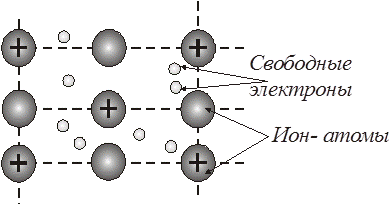
Рис. 4.27. Металлическая связь
Металлическая связь - это химическая связь, при которой валентные электроны принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла, причем эти электроны способны относительно свободно перемещаться в кристалле металла. Электроны, способные к перемещению в кристалле металла называют «электронным газом».
Между атомами и ионами, находящимися в узлах кристаллической решетки металла, существует динамическое равновесие:
Me D Me +n + ne–
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1149; Нарушение авторских прав?; Мы поможем в написании вашей работы!