
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ІІ блок «Теоретичні питання з тириметричного та фізико-хімічних методів аналізу». 2 страница
|
|
|
|
115.Обчислити рН 0,1 М розчину натрій гідрогенсульфіду.
116.Розрахувати співвідношення кислоти і спряженої основи в ацетатній буферній суміші з рН 4,2.
117.Яку масу натрій етанату (в г) потрібно додати до 200 мл 0,05 М розчину етанової кислоти, щоб одержати буферний розчин з рН 4,76? Обчислити буферну ємність такого розчину.
118.У 500 мл розчину міститься 0,82 г натрій етанату і 0,6 г етанової кислоти. Обчислити рН і буферну ємність цього розчину.
119.До 250 мл 0,1 М розчину NaНСО3 додали 2,65 г твердого Na2СО3. Обчислити рН одержаної буферної суміші.
120.Скільки грамів твердого натрій гідроксиду треба розчинити в 500 мл 0,10 М розчину етанової кислоти, щоб одержати буферний розчин, з рН 4,30?
121.Яку масу (в г) твердого Na2CO3 потрібно розчинити в 200 мл 0,1 М NaHCO3, щоб одержати буферний розчин з рН 10,0?
122.Розрахувати a (H3O+) і рН розчину, одержаного розведенням водою 5 мл 10,2 % водного розчину сульфатної кислоти (r = 1,070 г/мл) до загального об’єму 400,0 мл.
123.Скільки грамів етанової кислоти міститься у 300 мл її розчину з рН 4,0?
124.Скільки мг твердого натрій гідроксиду необхідно розчинити в 300 мл 0,05 М розчину соляної кислоти, щоб збільшити рН розчину на 3 одиниці?
125.Розрахувати pH розчину, одержаного змішуванням 200 мл 0,050 М розчину амоній хлориду і 5 мл 3 % розчину натрій гідроксиду (r = 1,03 г/мл).
V блок «Практичні завдання та задачі з гетерогенної рівноваги.»
1. Написати вираз термодинамічної та концентраційної константи розчинності Ва3(РО4)2.
2. Написати вираз термодинамічної та концентраційної константи розчинності Са3(РО4)2.
3. Написати вираз термодинамічної та концентраційної константи розчинності Ва3(AsО4)2.
4. Написати вираз термодинамічної та концентраційної константи розчинності Ва(BrО3)2.
5. Написати вираз термодинамічної та концентраційної константи розчинності Ag2C2O4.
6. Написати вираз термодинамічної та концентраційної константи розчинності Co(ОH)2.
7. Написати вираз термодинамічної та концентраційної константи розчинності Pb(SCN)2.
8. Написати вираз термодинамічної та концентраційної константи розчинності Mo(ОH)4.
9. Написати вираз термодинамічної та концентраційної константи розчинності Lа2(SО4)3.
10. Написати вираз термодинамічної та концентраційної константи розчинності Mn3(AsО4)2.
11. Розрахувати розчинність ВаSO4 у воді та в присутності 0,1 М розчину NaCl (KTS (BaSO4) = 1,1·10-10).
12. Розрахувати розчинність AgCl у воді та в 0,01 М розчині NаСl (KTS (AgCl) = 1,1·10-10).
13. Розрахувати розчинність BaCO3 у воді та в 0,01 М розчині KСl (KTS (BaCO3 ) = 4,0·10-10).
14. Розрахувати розчинність SrCrO4 у воді та в 0,03 М розчині NaNO3 (KTS (SrCrO4) = 3,6·10-5).
15. Розрахувати розчинність AgCl у воді та в 0,01 М розчині NаСl (KTS (AgCl) = 1,1·10-10).
16. Розрахувати розчинність Ca3(PO4)2 у воді та в 0,02 М розчині NаСl (KTS (Ca3(PO4)2) = 2,0·10-29).
17. Розрахувати розчинність AgSCN у воді та в 0,02 М розчині NaNO3 (KTS (AgSCN) = 1,1·10-10).
18. Розрахувати розчинність BaCrO4 у воді та в 0,05 М розчині NаСl (KTS (BaCrO4) = 1,2·10-10).
19. Розрахувати розчинність Ca(IO3)2 у воді та в 0,03 М розчині KNO3 (KTS (Ca(IO3)2) = 7,0·10-7).
20. Розрахувати розчинність BiPO4 у воді та в 0,05 М розчині Na2SO4 (KTS (BiPO4) = 1,1·10-10).
21. Розрахувати і порівняти розчинність аргентум хромату у воді та у 0,05 М розчині калій хромату.
22. Розрахувати і порівняти розчинність барій хромату у воді та у 0,1 М розчині калій хромату.
23. Розрахувати і порівняти розчинність арґентум хлориду у воді та у 0,1 М розчині калій хлориду.
24. Розрахувати і порівняти розчинність кальцій оксалату у воді та у 0,01 М розчині натрій оксалату.
25. Розрахувати і порівняти розчинність стронцій сульфату у воді та у 0,1 М розчині калій сульфату.
26. Розрахувати і порівняти розчинність гідраргірум(І) хлориду у воді та у 0,1 М розчині калій хлориду.
27. Розрахувати і порівняти розчинність плюмбум хромату у воді та у 0,1 М розчині калій хромату.
28. Розрахувати і порівняти розчинність плюмбум броміду у воді та у 0,02 М розчині калій броміду.
29. Розрахувати і порівняти розчинність арґентум тіоціанату у воді та у 0,1 М розчині натрій тіоціанату.
30. Розрахувати і порівняти розчинність кальцій фториду у воді та у 0,1 М розчині кальцій хлориду.
31. Розрахувати розчинність у воді (моль/л), якщо у 100 мл води розчиняється 0,058 г Hg2SO4.
32. Розрахувати розчинність у воді (моль/л), якщо у 100 мл води розчиняється 3,2·10-2 г Ag2CO3.
33. Розрахувати розчинність у воді (моль/л), якщо у 100 мл води розчиняється 6,8·10-16 г Ag2S.
34. Розрахувати розчинність у воді (моль/л), якщо у 100 мл води розчиняється 9,6·10-5 г Fe(OH)3.
35. Розрахувати розчинність у воді (моль/л), якщо у 100 мл води розчиняється 2,33·10-4 г BaSO4.
36. Розрахувати розчинність у воді (моль/л), якщо у 100 мл води розчиняється 6,0·10-4 г SrCO3.
37. Розрахувати константу розчинності аргентум хромату, якщо у 500 мл води розчиняється 0,011 г цієї солі.
38. Розрахувати константу розчинності кальцій фториду, якщо розчинність цієї солі у воді становить 2,1·10–4 моль/л.
39. Розрахувати константу розчинності аргентум хромату, якщо у 250 мл води розчиняється 0,0055 г цієї солі.
40. Розрахувати константу розчинності AgBrO3, якщо у 200 мл води розчиняється 0,35 г цієї солі.
41. Розрахувати константу розчинності барій пірофосфату, якщо у 100 мл води розчиняється 8,78·10–3 г Ва2Р2О7.
42. Розрахувати константу розчинності CuSCN, якщо в 500 мл води розчиняється 4,21·10–6 г цієї солі.
43. Розрахувати константу розчинності ZnSeO3, якщо в 200 мл води розчиняється 1,95·10–2 г цієї солі.
44. Розрахувати константу розчинності Ag2CrO4, якщо у 250,0 мл води розчиняється 0,006 г солі.
45. Розрахувати константу розчинності CuSCN, якщо в 500 мл води розчиняється 4,21·10–6 г цієї солі.
46. Розрахувати константу розчинності Ni(CN)2, якщо його розчинність у воді становить 2,17×10-6 г/л.
51. Яка із двох солей більш розчинна у воді і у скільки разів: BaCO3 чи SrСO3. Відповідь обґрунтувати.
52. Яка із двох солей більш розчинна у воді і у скільки разів: Ba2[Fe(CN)6] чи Co2[Fe(CN)6]. Відповідь обґрунтувати.
53. Яка із двох солей більш розчинна у воді і у скільки разів: Ca3(PO4)2 чи BiPO4. Відповідь обґрунтувати.
54. Яка із двох солей більш розчинна у воді і у скільки разів: Hg2Br2 чи PbBr2. Відповідь обґрунтувати.
55. Яка із двох солей більш розчинна у воді і у скільки разів: BaCrO4 чи SrCrO4. Відповідь обґрунтувати.
56. Яка із двох солей більш розчинна у воді і у скільки разів: Zn(CN)2 чи Cd(CN)2. Відповідь обґрунтувати.
57. Яка із двох солей більш розчинна у воді і у скільки разів: Ca(IO3)2 чи Pb(IO3)2. Відповідь обґрунтувати.
58. Яка із двох солей більш розчинна у воді і у скільки разів: CuC2O4 чи FeC2O4. Відповідь обґрунтувати.
59. Яка із двох солей більш розчинна у воді і у скільки разів: BaSO4 чи CaSO4. Відповідь обґрунтувати.
60. Яка із двох солей більш розчинна у воді і у скільки разів: Ni2[Fe(CN)6] чи Ni(IO3)2. Відповідь обґрунтувати.
61. Розрахувати pH насиченого розчину Mg(OH)2.
62. Розрахувати pH насиченого розчину Zn(OH)2.
63. Розрахувати pH насиченого розчину Co(OH)2.
64. Розрахувати pH насиченого розчину Cu(OH)2.
65. Розрахувати pH насиченого розчину Cd(OH)2.
66. Розрахувати pH насиченого розчину Pb(OH)2.
67. Розрахувати pH насиченого розчину Mn(OH)2.
68. Розрахувати pH насиченого розчину Ni(OH)2.
69. Розрахувати pH насиченого розчину Fe(OH)2.
70. Розрахувати розчинність ZnS в 1 М розчині CH3COOH.
71. Розрахувати розчинність: ZnS в розчині, що містить по 0,5 моль/л CH3COOH і CH3COONa.
72. Розрахувати розчинність NiS при [H3O+] = 10-2 моль/л.
73. Розрахувати розчинність Bi2S3 в розчині з pH = 0.
74. Розрахувати розчинність BaCrO4 в 2 М розчині CH3COOH.
75. Розрахувати розчинність CoS в розчині з pH = 1.
76. Розрахувати розчинність NiS в 2 М розчині CH3COOH.
77. Розрахувати розчинність SrCrO4 в 2 М розчині CH3COOH.
78. Розрахувати розчинність Ag2C2O4 в 2 М розчині CH3COOH.
79. Розрахувати розчинність Ag2C2O4 в розчині з pH = 0.
80. Який об’єм 10 % розчину хлоридної кислоти (ρ=1,02 г/мл) необхідно взяти для розчинення 0,35 г СаО?
81. Технічний барій хлорид містить 97 % ВаCl2·2Н2О. Яку наважку необхідно взяти для одержання 0,3 г осаду ВаSO4?
82. Який об’єм 2 %-го розчину NН4ОН необхідно взяти для осадження феруму із 0,2 г речовини, яка містить 20 % Fe2O3, якщо реагуючі речовини беруться у стехіометричних співвідношеннях?
83. Скільки мілілітрів хлоридної кислоти (ρ=1,15 г/мл) необхідно для осадження срібла у вигляді аргентум хлориду із 0,2 г речовини, яка містить 22 % срібла, якщо реагуючі речовини беруться у стехіометричних співвідношеннях?
84. Скільки мілілітрів 0,1 М барій хлориду необхідно взяти для осадження сірки у вигляді барій сульфату із наважки 2,0 г кам’яного вугілля, яке містить 4 % сірки, якщо осаджувач додати у стехіометричному співвідношенні?
85. Який об’єм 0,1 М розчину аргентум нітрату необхідний для осадження хлоридів із 2,0 г суміші, яка містить однакові кількості ВаCl2·2Н2О і NaCl (в грамах), якщо осаджувач доданий у стехіометричному співвідношенні?
86. Скільки мл 0,1 М розчину амоній оксалату необхідно взяти для осадження кальцію із 200 мл розчину, який містить в 1 л 0,555 г СаCl2, якщо осаджувач взятий у стехіометричному співвідношенні?
87. Який об’єм 5 % розчину амоніаку необхідно взяти для осадження феруму із 0,5 г речовини, яка містить 15 % Fe2O3, якщо реагуючі речовини беруться у стехіометричних співвідношеннях?
88. Скільки мілілітрів 10 % розчину калій хлориду (ρ=1,09 г/мл) необхідно для осадження срібла у вигляді аргентум хлориду із 0,3 г речовини, яка містить 25 % срібла, якщо реагуючі речовини беруться у стехіометричних співвідношеннях?
89. Який об’єм 5 %-ного розчину (NH4)2C2O4 (ρ=1,02 г/мл) необхідно взяти для осадження кальцій оксалату із наважки 0,5 г апатиту Са3(РО4)2·СаСl2 при стехіометричному співвідношенні реагуючих речовин?
90. Який об’єм 0,080 М розчину аргентум нітрату необхідний для осадження хлору із 3,5 г суміші, яка містить однакові кількості ВаCl2·2Н2О і NaNO3 (в грамах), якщо осаджувач доданий у стехіометричному співвідношенні?
91. Скільки мл 0,20 М розчину амоній оксалату необхідно взяти для осадження кальцію із 150 мл розчину, який містить в 1 л 0,345 г СаCl2, якщо осаджувач взятий у півтора кратному надлишку?
92. Скільки мл 0,1 М розчину амоній оксалату необхідно взяти для осадження стронцію із 200 мл розчину, який містить в 1 л 0,317 г SrCl2, якщо осаджувач взятий у стехіометричному співвідношенні?
93. Який об’єм 10 % розчину сульфатної кислоти (ρ=1,07 г/мл) необхідно взяти для перетворення 0,80 г PbО в PbSO4?
94. Скільки мл 0,1 М розчину амоній оксалату необхідно для осадження магнію із 250 мл розчину, який містить в 1 л 0,472 г MgCl2, якщо осаджувач взятий у стехіометричному співвідношенні?
95. Скільки мілілітрів 0,2 М барій хлориду необхідно взяти для осадження сірки у вигляді барій сульфату із наважки 1,5 г кам’яного вугілля, яке містить 6 % сірки, якщо осаджувач додати у стехіометричному співвідношенні?
96. Технічний кальцій хлорид містить 93 % СаCl2·2Н2О. Яку наважку необхідно взяти для одержання 0,7 г осаду СаSO4?
97. Розрахувати фактор перерахунку при визначенні барію у вигляді ВаSO4.
98. Розрахувати фактор перерахунку при визначенні феруму у вигляді Fe2O3.
99. Розрахувати фактор перерахунку при визначенні магнію у вигляді MgNH4PO4.
100.Розрахувати фактор перерахунку при визначенні магнію у вигляді Mg2P2O7.
101.Розрахувати фактор перерахунку при визначенні алюмінію у вигляді Al2O3.
102.Розрахувати фактор перерахунку при визначенні фосфору у вигляді (NH4)3PO4·12MoO3.
103.Розрахувати фактор перерахунку при визначенні фосфору(V) оксиду (P2O5) у вигляді Mg2P2O7.
104.Розрахувати фактор перерахунку при визначенні кальцію у вигляді CaC2O4.
105.Розрахувати фактор перерахунку при визначенні купруму у вигляді CuS.
106.Розрахувати фактор перерахунку при визначенні алюмінію у вигляді алюміній оксихінолінату – Al(C9H6ON)3.
VІ блок «Практичні завдання та задачі з титриметричного аналізу та фотометрії.»
1. Який об’єм хлоридної кислоти з масовою часткою ω(HCl) = 30,1 %, (ρ = 1,15 г/см3) необхідно для приготування 1,0 л розчину з концентрацією 0,10 моль·екв/л?
2. Який об’єм сульфатної кислоти з масовою часткою ω(H2SO4) = 91,1 %, (ρ = 1,82 г/см3) необхідно для приготування 1,0 л 0,2 н розчину (f екв(H2SO4) = 1/2)?
3. Який об’єм розчину сульфатної кислоти з масовою часткою 9,3 % (ρ = 1,05 г/см3) потрібно для приготування 50 мл 0,35 М розчину H2SO4?
4. Який об’єм розчину натрію карбонату з масовою часткою 15 % (ρ = 1,16 г/см3) потрібно для приготування 200 мл 0,45 М розчину Na2CO3?
5. Який об’єм розчину натрію гідроксиду з масовою часткою 25 % (ρ = 1,18 г/см3) потрібно для приготування 250 мл 0,45 М розчину NaОН?
6. У воді розчинили 28,000 г NaOH і розвели водою до 1,000 л. Яка молярна концентрація одержаного розчину?
7. До 900,0 мл 0,25 М розчину HCl добавили 100,0 мл води. Обчислити молярну концентрацію і титр одержаного розчину.
8. Який об’єм води потрібно додати до 850 мл 0,5300 М розчину HCl, щоб одержати 0,500 М розчин?
9. Визначити концентрацію (моль/л) і титр 20 % розчину H2SO4, а також його титр по СаО (ρ(H2SO4) = 1,140 г∕см3).
10. Обчислити молярну концентрацію і титр розчину HCl, якщо на титрування 25,0 мл 0,075 н розчину бури (Na2B4O7) витрачено 19,75 мл цієї кислоти.
11. Обчислити молярну концентрацію і титр розчину HCl, якщо на титрування 21,0 мл 0,055 н розчину натрій карбонату витрачено 22,75 мл цієї кислоти.
12. Наважку H2C2O4·2H2O масою 0,6000 г розчинили у мірній колбі об’ємом 250,0 мл. На титрування 20,0 мл одержаного розчину витратили 18,24 мл розчину NaOH. Визначити молярну концентрацію розчину NaOH і його титр по H2C2O4.
13. Обчислити молярну концентрацію KOH, якщо на титрування 15,00 мл його розчину витрачено 18,70 мл розчину HCl (T (HCl) = 0,002864 (мг/мл)).
14. Обчислити молярну концентрацію NaOH, якщо на титрування 16,00 мл його розчину витрачено 17,50 мл розчину HCl (T (HCl) = 0,004864 (мг/мл)).
15. На титрування розчину, який містить 3,1580 г технічного КОН затрачено 27,45 мл розчину HCl ( =0,0786 г). Вирахувати процентний вміст КОН у зразку.
=0,0786 г). Вирахувати процентний вміст КОН у зразку.
16. Скільки грамів лугу, який містить 98% NaOH і 2% індеферентних домішок, необхідно для приготування 200 мл 0,1 М розчину.
17. Яку масу ЕДТА (Na2H2C10H12O8N2·2H2O) необхідно для приготування 250,0 мл 0,010 М розчину?
18. Яка масу металічного цинку (ω (Zn) = 99,99 %) необхідно взяти для приготування 100,00 мл розчину, на титрування 20,00 мл якого витрачається 20,00 мл 0,2000 М ЕДТА?
19. Яка масу металічного магнію (ω (Mg) = 99,99 %) необхідно взяти для приготування 200,00 мл розчину, на титрування 10,00 мл якого витрачається 11,50 мл 0,1500 М ЕДТА?
20. Розрахувати нормальність і титр розчину трилону Б, якщо на титрування 20,00 мл витрачено 25,00 мл 0,2000 н MgSO4.
21. Визначити % вміст індеферентних домішок в HgSO4×7H2O, якщо після розчинення наважки 0,1000 г магній відтитрувався 7,32 мл 0,05000 М трилону Б.
22. При визначенні карбонатної твердості на титрування 200 мл проби води витратили 10,25 мл розчину 0,1 М HCl. При визначенні загальної твердості, на титрування 10 мл цієї ж води витратили 15,12 мл 0,050 М розчину ЕДТА кислоти. Обчислити карбонатну, загальну і постійну твердість води (ммоль/л).
23. На титрування 20,00 мл розчину FeSO4 в сірчанокислому середовищі витратили 22,50 мл 0,1000 М розчину K2Cr2O7 (fекв. = 1/6). Яка маса (мг) феруму міститься в пробі?
24. Наважку металічної міді масою 0,1530 г розчинили, до розчину добавили надлишок KI і на титрування I2, який виділився в результаті реакції витратили 24,18 мл розчину Na2S2O3. Обчислити молярну концентрацію еквівалента розчину Na2S2O3.
25. На окиснення наважки Na2C2O4 масою 0,2000 г в кислому середовищі витратили 25,00 мл розчину KMnO4. Яка концентрація розчину калій перманганату (моль·екв/л)?
26. На окиснення наважки Na2SO3 масою 0,2000 г в кислому середовищі витратили 25,00 мл розчину KCr2O7. Яка концентрація розчину калій біхромату (моль·екв/л)?
27. Розрахувати % вміст міді в руді, якщо із наважки 0,6215 г руди мідь перевели в розчин у вигляді Cu2+, при добавлені до цього розчину KJ виділився J2, на титрування якого затрачено 18,23 мл розчину Na2S2O3 (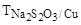 =0,006208).
=0,006208).
28. Яка маса купруму (у мг) містилася у зразку, якщо після його розчинення та додавання надлишку KI, на титрування йоду що виділився витрачено 9,80мл 0,1057н розчину Na2S2O3.
29. Скільки гр. Н2С2О4×2Н2О міститься в мірній колбі ємністю 500 мл, якщо на титрування 25 мл цього розчину витрачено 30,25 мл розчину KMnO4 з Т=0,001580?
30. Знайдіть нормальність та титр (г/мл) розчину, який містить 0,1133 г K2Cr2O7 в 0,5 л води.
31. На яку величину (у мВ) зміниться редокс потенціал системи 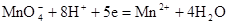 зі зміною рН на одиницю при Т = 303К.
зі зміною рН на одиницю при Т = 303К.
32. Обчислити стрибок окисно-відновного потенціалу при титруванні розчину FeSO4 розчином KMnO4 між недостачею і надлишком останнього в 0,1%.
33. Обчисліть значення редокс потенціалу (у В) в точці еквівалентності при перманганатометричному визначенні феруму.
34. Обчисліть значення константи рівноваги реакції: 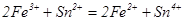 .
.
35. Наважку руди масою 0,1105г шляхом розчинення переведено в розчин. Ферум, який містився в пробі відновлено до Fe2+ і відтитровано 8,70 мл 0,1068н розчином KMnO4. Знайти вміст Феруму (у відсотках) у пробі.
36. Яка оптична густина розчину, якщо його світлопропускання дорівнює 10 %?
37. Яке світлопропускання розчину (%), якщо його оптична густина дорівнює 0,100?
38. Кювета з якою товщиною поглинаючого шару (у см) була використана для фотометричних досліджень, якщо оптична густина 0,05 ммоль/л розчину дорівнює 0,110, молярний коефіцієнт світлопоглинання 2200 л/(моль·см)?
39. При фотометруванні розчину в кюветі з товщиною поглинаючого шару 1,0 см одержали оптичну густину 0,110. Яка концентрація досліджуваного розчину (у ммоль/л), якщо молярний коефіцієнт світлопоглинання дорівнює 2200 л/(моль·см)?
40. При фотометруванні 0,05 ммоль/л розчину в кюветі з товщиною поглинаючого шару 1,0 см одержали оптичну густину 0,110. Розрахувати значення молярного коефіцієнта світлопоглинання.
41. Молярний коефіцієнт поглинання моносульфосаліцилату феруму (III) при λ = 520 нм становить ε = 6·103. Розрахувати концентрацію Fe3+ (мг/мл) в розчині, якщо оптична густина розчину, виміряна в кюветі l = 2,0 см дорівнює А = 0,325.
42. Для визначення нікелю з диметилгліоксимом наважку сталі масою 0,3000 г розчинили і розчин помістили в колбу об’ємом 100 мл. До 5,0 мл одержаного розчину додали необхідні реактиви, розвели до 50,0 мл і фотометрували при l = 1,0 см, λ = 520 нм, ε = 1,3·104. Розрахувати масову частку (%) нікелю в сталі, якщо оптична густина розчину дорівнює A = 0,325.
43. Наважку сталі масою 0,5000г розчинили в колбі, об’ємом 50,0 мл. Дві проби по 20,0 мл помістили в колби, об’ємом 50,0 мл. В одну колбу добавили розчин, який містить 3,00 мг ванадію. В обидві колби добавили гідрогенпероксид і довели до мітки водою. Розрахувати масову частку ванадію в сталі (%), якщо при фотометруванні розчинів одержали наступні значення оптичної густини Ax 0,200 і Ax+доб 0,480.
44. Наважку сталі масою 0,6572г розчинили в колбі, об’ємом 50,0 мл. Дві проби по 20,0 мл помістили в колби, об’ємом 50,0 мл. В одну колбу добавили розчин, який містить 3,00 мг ванадію. В обидві колби добавили гідрогенпероксид і довели до мітки водою. Розрахувати масову частку ванадію в сталі (%), якщо при фотометруванні розчинів одержали наступні значення оптичної густини Ax 0,230 і Ax+доб 0,510.
45. Наважку сталі масою 0,7468г розчинили в колбі, об’ємом 50,0 мл. Дві проби по 20,0 мл помістили в колби, об’ємом 50,0 мл. В одну колбу добавили розчин, який містить 3,00 мг ванадію. В обидві колби добавили гідрогенпероксид і довели до мітки водою. Розрахувати масову частку ванадію в сталі (%), якщо при фотометруванні розчинів одержали наступні значення оптичної густини Ax 0,250 і Ax+доб 0,530.
46. Наважку сталі масою 0,9580г розчинили в колбі, об’ємом 50,0 мл. Дві проби по 20,0 мл помістили в колби, об’ємом 50,0 мл. В одну колбу добавили розчин, який містить 3,00 мг ванадію. В обидві колби добавили гідрогенпероксид і довели до мітки водою. Розрахувати масову частку ванадію в сталі (%), якщо при фотометруванні розчинів одержали наступні значення оптичної густини Ax 0,280 і Ax+доб 0,560.
47. У дві мірні колби об’ємом 100,0 мл помістили по 10,0 мл стічної води. В одну колбу добавили 10,00 мл стандартного розчину CuSO4 з T (Cu) = 0,00100 г/мл. В обидві колби добавили розчину амоніаку, рубеановодневої кислоти і довели водою до мітки. При фотометруванні одержали наступні значення оптичних густин Ax 0,240 і Ax+доб 0,380. Визначити концентрації купруму (г/мл) в стічній воді.
48. У дві мірні колби об’ємом 100,0 мл помістили по 20,0мл стічної води. В одну колбу добавили 10,00 мл стандартного розчину CuSO4 з T (Cu) = 0,00100 г/мл. В обидві колби добавили розчину амоніаку, рубеановодневої кислоти і довели водою до мітки. При фотометруванні одержали наступні значення оптичних густин Ax 0,280 і Ax+доб 0,320. Визначити концентрації купруму (г/мл) в стічній воді.
49. У дві мірні колби об’ємом 100,0 мл помістили по 30,0мл стічної води. В одну колбу добавили 10,00 мл стандартного розчину CuSO4 з T (Cu) = 0,00100 г/мл. В обидві колби добавили розчину амоніаку, рубеановодневої кислоти і довели водою до мітки. При фотометруванні одержали наступні значення оптичних густин Ax 0,320 і Ax+доб 0,460. Визначити концентрації купруму (г/мл) в стічній воді.
50. У дві мірні колби об’ємом 100,0 мл помістили по 40,0 мл стічної води. В одну колбу добавили 10,00 мл стандартного розчину CuSO4 з T (Cu) = 0,00100 г/мл. В обидві колби добавили розчину амоніаку, рубеановодневої кислоти і довели водою до мітки. При фотометруванні одержали наступні значення оптичних густин Ax 0,400 і Ax+доб 0,540. Визначити концентрації купруму (г/мл) в стічній воді.
51. Обчислити оптичну густину розчину, виміряну при 366 нм, що містить за сумісної присутності 0,10 ммоль/л комплексонату плюмбуму та 0,010 ммоль/л комплексонату бісмуту, якщо їх молярні коефіцієнти світлопоглинання дорівнюють: 900 та 10000 відповідно, а товщина поглинаючого шару l = 30,0 мм.
52. Розрахувати, яку мінімальну масу феруму (ІІІ) (у мг) можна визначити за реакцією з сульфосаліциловою кислотою в аміачному середовищі при використанні кювети з товщиною шару 5 см; об’єм забарвленого розчину дорівнює 20 мл; коефіцієнт молярного поглинання дорівнює 4000 л/(моль·см); мінімальна оптична густина, яка вимірюється приладом, становить 0,011.
53. Коефіцієнт молярного світлопоглинання калій манганату (VII) при довжині хвилі 546 нм 2420 л/(моль·см). Оптична густина досліджуваного розчину в кюветі товщиною шару 2 см дорівнює 0,80. Знайти титр (г/мл) КMnO4/Mn.
54. Обчислити молярний коефіцієнт поглинання забарвленого розчину ферум(3+)-іона з сульфосаліциловою кислотою, який містить 4´10-3 г/л Fe(III), якщо товщина шару 2 см, а оптичне поглинання 0,56.
55. Пропускання для забарвленого розчину при l=625 нм дорівнює 35,40%. Розрахувати оптичну густину цього розчину.
56. Енергія електромагнітного випромінювання у видимій області спектра становить 400 кДж/моль. 1) Яка довжина хвилі цього випромінювання (нм)? 2. Обчислити величину хвильового числа для цього випромінювання.
57. Який фотометичний метод визначення Кобальту найбільш придатний для виявлення його слідової кількості ~10-4моль/л: [Co(SCN)4]2– (e=103) чи [Co(H2O)6]2+ (e=10)? (у формі тіоціанату).
58. Молярний коефіцієнт поглинання забарвленого комплексу ніколу з a-бензоїлоксимом при l=406 нм має значення e=12000. Обчислити, яку мінімальну концентрацію Ніколу (мг/мл) можна визначити фотометрично у кюветі завтовшки 5,0 см, якщо мінімальне вимірюване значення оптичної густини - 0,020.
59. Фотометрування розчинів сполуки бісмуту (ІІІ) з тіомочевиною можна проводити як при l=470 нм (e=9×103), так і при l=322 нм (e=35×103). В якому випадку межа виявлення нижча?
60. Оптична густина розчину трисульфосаліцилату Феруму (ІІІ), виміряна при l=433 нм у кюветі завтовшки 2,0 см, становить 0,276. Для одержання забарвленої сполуки взято 4,00 мл 4,3×10-5 М розчину солі Феруму (ІІІ); реагент та об’єм розчину довели у мірній колбі до 50,00 мл. Обчислити величину молярного конфіцієнта поглинання цього розчину.
|
|
|
|
|
Дата добавления: 2015-05-29; Просмотров: 705; Нарушение авторских прав?; Мы поможем в написании вашей работы!