
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродные потенциалы
|
|
|
|
При контакте металла с раствором электролита на границе металл – жидкость возникает двойной электрический слой. Образование двойного электрического слоя сопровождается появлением межфазной разности потенциалов, которая в электрохимии называется электродным потенциалом. Если ограничиться рассмотрением системы, состоящей из металла, помещенного в раствор собственной соли, то величина электродного потенциала зависит от природы металла и раствора, количественного состава раствора и температуры. Эта зависимость выражается уравнением Нернста, которое для температуры 298 К (25 °С) записывается в виде
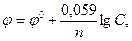
где 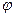 - электродный потенциал, В;
- электродный потенциал, В; 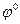 - стандартный электродный потенциал – электродный потенциал, измеренный при стандартных условиях (
- стандартный электродный потенциал – электродный потенциал, измеренный при стандартных условиях (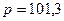 кПа;
кПа; 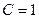 моль/л;
моль/л; 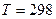 К);
К); 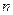 - число электронов, участвующих в электрохимическом процессе;
- число электронов, участвующих в электрохимическом процессе; 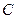 - концентрация (при точных вычислениях – активность) ионов металла в растворе, моль/л.
- концентрация (при точных вычислениях – активность) ионов металла в растворе, моль/л.
Пример 1. Определить электродный потенциал никеля, помещенного в раствор собственной соли с концентрацией ионов 0,001 моль/л.
Решение: Стандартный электродный потенциал никеля равен 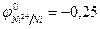 В.
В.
Электродный процесс описывается реакцией
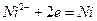 .
.
Поэтому согласно уравнению Нернста
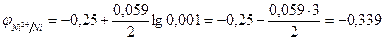 В.
В.
Располагая металлы по возрастанию стандартного электродного потенциала, получим ряд напряжений металлов.
Положение того или иного металла в этом ряду характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение стандартного электродного потенциала (чем левее располагается металл в ряду напряжений), тем более сильным восстановителем является сам металл и тем более слабым окислителем будет его ион.
Система, состоящая из металла, помещенного в раствор электролита, называется электродом или полуэлементом. Комбинация двух разных полуэлементов, соединенных через пористую перегородку или посредством электрохимического мостика, называется гальваническим элементом. При работе гальванического элемента на одном из его электродов – аноде - идет процесс окисления, при этом металл заряжается отрицательно, а на втором электроде – катоде – идет процесс восстановления. Катод заряжается положительно.
Анодом в гальваническом элементе будет металл, электродный потенциал которого меньше (металл располагается левее в ряду напряжений). Роль катода играет металл, электродный потенциал которого больше (металл в ряду напряжений располагается правее).
ЭДС (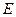 ) гальванического элемента определяется по формуле
) гальванического элемента определяется по формуле
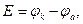
где 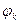 - потенциал катода;
- потенциал катода; 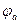 - потенциал анода.
- потенциал анода.
Пример 2. Составьте схему гальванического элемента, в котором электродами являются магний и цинк, опущенные в растворы их солей с концентрацией ионов 1 моль/л. Определите катод и анод, напишите уравнения электродных процессов и суммарной окислительно-восстановительной реакции и вычислите ЭДС гальванического элемента.
Решение: Схема данного гальванического элемента запишется в виде
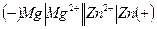 .
.
Магний имеет меньший стандартный потенциал (-2,37 В), поэтому является анодом. На аноде протекает процесс окисления
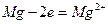 .
.
Стандартный электродный потенциал цинка (-0,763 В) больше, чем потенциал магния, поэтому цинк – катод. На этом электроде протекает процесс восстановления
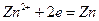 .
.
Суммарное уравнение окислительно-восстановительной реакции имеет вид
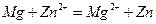 .
.
ЭДС гальванического элемента равна
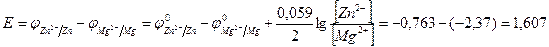 В.
В.
Контрольные вопросы
421. В два сосуда с голубым раствором сульфата меди поместили в первый цинковую, а во второй – серебряную пластинку. В каком соседе и почему раствор постепенно обесцветится? Составьте уравнения соответствующих реакций.
422. Запишите схемы процессов, протекающих в гальваническом элементе Zn | Zn(NO3)2 || Ni(NO3)2 | Ni
и рассчитайте его ЭДС, если концентрация нитрата цинка равна 0,01 моль/л, а нитрата никеля – 1 моль/л.
423. Запишите схемы процессов, протекающих в гальваническом элементе Cu | Cu(NO3)2 || AgNO3 | Ag
и рассчитайте его ЭДС, если концентрация нитрата меди равна 0,001 моль/л, а концентрация нитрата серебра – 0,1 моль/л.
424. Запишите схемы процессов, протекающих в гальваническом элементе Mn | Mn(NO3)2 || Sn(NO3)2 | Sn
и рассчитайте его ЭДС, если концентрация раствора нитрата марганца равна 0,001 моль/л, а нитрата олова – 0,5 моль/л.
425. Запишите схемы процессов, протекающих в гальваническом элементе Zn | ZnSO4 || Fe2(SO4 )3 | Fe
и рассчитайте его ЭДС, если концентрация сульфата цинка равна 0,01моль/л, а сульфата железа – 0,005 моль/л.
426. Запишите схемы процессов, протекающих в гальваническом элементе Zn | ZnSO4 || AgNO3 | Ag
и рассчитайте его ЭДС, если концентрация сульфата цинка равна 0,0001 моль/л, а нитрата серебра – 0,1 моль/л.
427. Запишите схемы процессов, протекающих в гальваническом элементе Ni | Ni(NO3)2 || Sn(NO3)2 | Sn
и рассчитайте его ЭДС, если концентрация нитрата никеля равна 0,0001 моль/л, а нитрата олова – 0,1 моль/л.
428. Запишите схемы процессов, протекающих в гальваническом элементе Cr | Cr(NO3)3 || AgNO3 | Ag
и рассчитайте его ЭДС, если концентрация нитрата хрома равна 0,1 моль/л, а нитрата серебра – 0,00001 моль/л.
429. Запишите схемы процессов, протекающих в гальваническом элементе Mn | Mn(NO3)2 || Ni(NO3)2 | Ni
и рассчитайте его ЭДС, если концентрация нитрата марганца равна 0,01 моль/л, а нитрата никеля – 0,5 моль/л.
430. Запишите схемы процессов, протекающих в гальваническом элементе Zn | Zn(NO3)2 || Sn(NO3)2 | Sn
и рассчитайте его ЭДС, если концентрация нитрата цинка равна 0,01 моль/л, а нитрата олова – 0,000001 моль/л.
431. Запишите схемы процессов, протекающих в гальваническом элементе Cd | Cd(NO3)2 || Cu(NO3)2 | Cu
и рассчитайте его ЭДС, если концентрация нитрата кадмия равна 0,0001моль/л, а нитрата меди – 1 моль/л.
432. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) 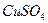 ; б)
; б) 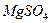 ; в)
; в) 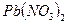 ? Составьте уравнения соответствующих реакций.
? Составьте уравнения соответствующих реакций.
433. Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов марганца..
434. Потенциал серебряного электрода в растворе нитрата серебра составил 95% от значения его стандартного электродного потенциала. Определите концентрацию ионов серебра в растворе..
435. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором концентрация ионов кадмия составляет 0,8 моль/л, а ионов меди – 0,01 моль/л..
436. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Для каждого из этих элементов напишите уравнения катодного и анодного процессов.
437. При какой концентрации ионов меди в растворе значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода?.
438. Какой гальванический элемент называют концентрационным? Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, помещенных первый в 0,01 н., а второй в 0,1 н. растворы нитрата серебра.
439. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из никелевых электродов, помещенных первый в 0,001 моль/л, а второй в 0,01 моль/л растворы сульфата никеля.
.
440. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей. Концентрации ионов свинца и магния одинаковы и составляют 0,1 моль/л. Изменится ли ЭДС, если концентрацию каждого из ионов увеличить в одинаковое число раз?
.
441. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из кадмиевой и магниевой пластин, опущенных в растворы своих солей. Концентрация ионов кадмия и магния одинакова и составляет 1 моль/л. Изменится ли ЭДС, если концентрацию каждого из ионов уменьшить до 0,01 моль/л?
.
442. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите уравнения катодного и анодного процессов. Какой концентрации необходимо взять ионы железа (II), чтобы ЭДС гальванического элемента стала равной нулю при условии, что концентрация ионов цинка равна 0,001 моль/л?
443. Составьте схему гальванического элемента, в основе которого лежит реакция 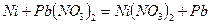 .
.
Напишите уравнения анодного и катодного процессов. Вычислите ЭДС, если концентрация ионов никеля равна 0,01 моль/л, а ионов свинца – 0,0001 моль/л.
.
444. Потенциал медного электрода в растворе нитрата меди составил 50% от значения его стандартного электродного потенциала. Определите концентрацию ионов меди в растворе.
445. Во сколько раз изменится электродный потенциал серебряного электрода, если концентрацию ионов серебра уменьшить в 1000 раз?
446. При какой концентрации ионов кобальта в растворе, электродный потенциал кобальтового электрода станет больше электродного потенциала никелевого электрода, если концентрация ионов никеля составляет 0,00001 моль/л?
447. При какой концентрации ионов водорода в растворе, электродный потенциал водородного электрода равен стандартному электродному потенциалу свинца?
448. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
449. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
450. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
|
|
|
|
Дата добавления: 2015-05-31; Просмотров: 9468; Нарушение авторских прав?; Мы поможем в написании вашей работы!