
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Проводится набор в секцию 4 страница
|
|
|
|
Теорема Купманса - если удалить с орбитали ci один электрон (ионизировать атом или молекулу), то, считая, что после удаления электрона распределение остальных электронов останется “замороженным”, изменение энергии системы можно приближенно записать как 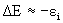 . Хартри-фоковские орбитальные энергии ei дают оценку потенциалов ионизации. Использование теоремы Купманса оправдано для молекул с жесткой структурой (для сопряженных углеводородов и др.), не изменяющих свою геометрию при ионизации.
. Хартри-фоковские орбитальные энергии ei дают оценку потенциалов ионизации. Использование теоремы Купманса оправдано для молекул с жесткой структурой (для сопряженных углеводородов и др.), не изменяющих свою геометрию при ионизации.
Теория групп – математическая теория симметрии. В квантовой химии применяется для подбора подходящей линейной комбинации атомных орбиталей при построении молекулярных орбиталей молекулы, для классификации атомных и молекулярных состояний, определения правил отбора для переходов между этими состояниями и нахождения нормальных колебаний молекул.
Теория кристаллического поля – объясняет электронное строение комплекса в терминах возмущения АО центрального атома электростатическим полем лигандов, считающихся отрицательными точечными зарядами. Это возмущение полагается малым и приводит лишь к расщеплению энергетических уровней d- или f-элемента. Электронная конфигурация центрального атома рассматривается явно, тогда как лиганды – феноменологически. Распределение валентных электронов по расщепленным энергетическим уровням центрального атома определяется его сортом, величиной отталкивания электронов центрального атома от лигандов и взаимодействием электронов между собой.
Теория возмущений Мёллера-Плессета -теория возмущений, применяемая для учета многоэлектронных эффектов. Эффекты, вносимые корреляцией в движении электронов в каждый момент времени, учитываются как поправки к невозмущенным волновым функциям и уровням энергии, получаемым при расчетах по методу Хартри-Фока (в которых эффект электронной корреляции не учитывается в силу введенных приближений – приближения независимых частиц и самосогласованного поля). Разница между точным гамильтонианом H (где корреляция электронов учтена) и гамильтонианом нулевого порядка H0 , в качестве которого выбирают оператор Фока F, рассматривается как возмущение: Н' = H – F. Уже учет поправок второго порядка теории возмущений позволяет учесть большую часть энергии электронной корреляции и значительно улучшает вычисления по сравнению с методом Хартри-Фока. Теория возмущений Мёллера-Плессета пригодна для описания дисперсионных взаимодействий, водородных связей и переходных состояний.
Теория поля лигандов - наиболее общий подход к рассмотрению электронной структуры комплексов. Рассматривает комплекс как целое на основе метода молекулярных орбиталей. Ввиду высокой симметрии координационного узла МО молекулы или иона координационного соединения классифицируются по симметрийным свойствам и принципиальную схему их образования из орбиталей лигандов часто можно построить, не проводя конкретных расчетов. Теория поля лигандов дает количественную картину образования МО комплекса.
Теория функционала плотности (ТФП, англ. - DTF). Согласно этой теории, все электронные свойства системы, включая энергию, могут быть получены из электронной плотности без знания волновых функций. Кинетическая энергия электронов описывается явно в приближении независимых частиц, классическая часть потенциальной энергии описывается по закону Кулона. Обмен и электронная корреляция учитываются приближенно. Расчеты по ТФП требует меньше компьютерного времени, чем вычисления другими методами, позволяя рассчитывать характеристики молекулярных систем с большим количеством атомов.
Топологическая теория химической связи, молекулярной и кристаллической структуры – основана на анализе электронной плотности. Строение многоэлектронной системы при ядерной конфигурации R определяется набором и сортами критических точек электронной плотности r(r,R) - точек r c, где градиент электронной плотности Ñr(r,R) равен нулю. Пары градиентных траекторий, которые заканчиваются в двух соседних ядрах, начинаются в критической точке, имеющей одну положительную и две отрицательных значений кривизны электронной плотности (критической точке связи), определяют линию связи. Все траектории, которые заканчиваются на некотором ядре, определяют область пространства химической системы, которая называется бассейном этого ядра. Совокупность ядра и электронная плотность в пределах его бассейна определяет атом в химической системе. Каждая пара смежных бассейнов разделяется межатомной поверхностью, поток вектора rÑ через которую равен нулю. Таким образом, любая межатомная поверхность образуется градиентными траекториями, которые заканчиваются в критической точке связи r b, лежащей на этой же поверхности. Если электронная плотность в критической точке связи превышает среднее значение электронной плотности в соседних точках, то лапласиан электронной плотности Ñ2r(r b) < 0; это признак концентрации электронов, характерный для ковалентной связи. В случае Ñ2r(r b) > 0 наблюдается деконцентрация электронов. Лапласиан электронной плотности прямо связан с локальными вкладами в электронную энергию молекулы и кристалла плотностей кинетической g(r) и потенциальной v(r) энергий (ħ2/4m)Ñ2ρ(r) = 2G(r) +V(r). Поскольку g>0, a v<0, то в областях, где происходит концентрация электронов, плотность потенциальной энергии выше.
Анализ лапласиана электронной плотности Ñ2ρ(r) в критической точке связи позволяет разделить все атомные взаимодействия на два класса. Если для электронной плотности здесь характерно доминирование отрицательной кривизны, то это означает, что электроны концентрируются вокруг критической точки связи и взаимодействие атомов можно отнести к ковалентному типу. Потенциальная энергия электронов в области, окружающей точку r b, по меньшей мере, в два раза будет превосходить кинетическую энергию. Если же в точке r b доминирует положительная кривизна электронной плотности, то электроны оказываются смещенными к каждому из взаимодействующих атомов и сконцентрированной в атомных бассейнах. Такие атомные взаимодействия считаются взаимодействиями ионного типа. В области, окружающей критическую точку связи, доминирует кинетическая энергия, а области, где доминирует потенциальная энергия, оказываются пространственно-разделенными.
Туннельный эффект – квантово-механическое явление прохождения частиц через потенциальный барьер. Возможность туннельного прохождения барьера проистекает из требования непрерывности волновой функции на стенках ямы до и после барьера. Вероятность туннельного прохождения тем меньше, чем выше высота относительная барьера и больше масса частицы. Очень эффективно совершают туннельное прохождение электроны, хуже - протоны.
Узлы волновых функций – точки, линии или поверхности, в которых волновые функции обращаются в нуль. Таким образом, вероятность найти электрон в узле равна нулю. Число узлов атомной радиальной функции равно n-l-1, ее угловой составляющей равно l, общее число узлов равно n-1.
Уравнения Рутана -уравнения Хартри-Фока при представлении МО (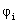 ) в виде линейной комбинации АО
) в виде линейной комбинации АО  :
: 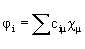 . Имеют вид
. Имеют вид 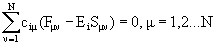 …
…
Элементы матрицы Фока в приближении МО ЛКАО
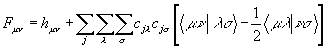
состоят из следующих членов: 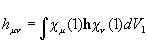 - одноэлектронный остовный интеграл,
- одноэлектронный остовный интеграл, 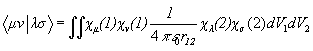 - двухэлектронный кулоновский интеграл,
- двухэлектронный кулоновский интеграл,  - двухэлектронный обменный интеграл.
- двухэлектронный обменный интеграл.
Sij –элементы матрицы интегралов перекрывания между АО cm и cn, Еi - одно из решений секулярного уравнения.
Уровень Ферми - высшая орбиталь в твердом теле, заполненная электронами.
Функция Блоха – волновая функция электрона в кристалле, обладающая трансляционными свойствами и являющаяся собственной функцией одноэлектронного гамильтониана с трансляционно-симметричной потенциальной энергией, имеет вид u k (r) = Nexp(i kr)f k (r). Здесь f k (r) – периодическая в кристаллической решетке функция, а N – нормировочный множитель. Функции Блоха играют в кристалле роль базисных функций.
Х
Хартри – атомная единица энергии. 1 Хартри= 2625.5 кдж/мoль=627.5 ккал/мoль=27.211 эв= 219474.6 cм-1.
Химическая точность – точность в определении значений энергетических характеристик атомов, молекул, молекулярных ансамблей и кристаллов по результатам квантово-химических расчетов не более ± 10 кДж/моль.
Четность (нечетность) молекулярной орбитали – определяется тем, меняет или нет МО знак при инверсии относительно центра симметрии. Соответственно, МО обозначаются индексами g (gerade - четный) и u (ungerade - нечетный). Четность и нечетность МО лежат в основе правил отбора разрешенных электронных переходов: возможны переходы u «g и невозможны переходы u «u и g «g.
Эквивалентная орбиталь – молекулярная орбиталь входит в набор эквивалентных орбиталей, если операция симметрии, примененная к молекуле, преобразует эту орбиталь в другую орбиталь этого набора. Понятие эквивалентной орбитали тесно связано с гибридизацией и локализацией орбиталей.
Эксимерные молекулы – молекулы неустойчивые в основном состоянии. Стабильны и спектроскопически наблюдаемы в возбужденном состоянии и в виде ионов (пример, Не2 и Ве2).
Электронная конфигурация атома - определенное распределение электронов по оболочкам: 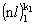 ,
, 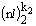 ,
, 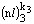 ....,
...., 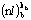 . Не является строгим физическим понятием, а зависит от приближения, в котором рассматривается атомная электронная структура.
. Не является строгим физическим понятием, а зависит от приближения, в котором рассматривается атомная электронная структура.
Электронная корреляция – эффект, обусловленный мгновенным кулоновским отталкиванием между электронами (стремлением электронов «избежать друг друга»). Его учет приводит к более низкому значению полной энергии системы. Не учитывается в методе Хартри-Фока. Изменение энергии, вызванное этими мгновенными кулоновскими взаимодействиями, называется энергией корреляции: Eкорреляц. = Eточн. - EХФ < 0. Учет электронной корреляции особенно важен при исследовании эффектов, зависящих от возбужденных состояний или плохо описываемых в однодетерминантном приближении.
Электронная плотность – мера «плотности» электронного облака в данном месте, плотность вероятности присутствия электронов. Функция определена во всем пространстве. Электронная плотность r(r), связана с многоэлектронной волновой функцией соотношением
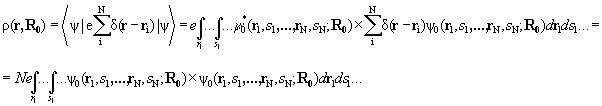
Здесь 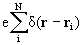 – оператор локальной плотности электрона в точке ri, интегрирование по спиновым переменным эквивалентно суммированию по направлениям спинов, суммирование по электронам вследствие их неразличимости заменено умножением на N. ЭП есть средняя по межэлектронным взаимодействиям плотность N электронов в основном состоянии. Она зависит только от координат рассматриваемых точек пространства r (тогда как волновая функция зависит от координат и спинов всех электронов). Интеграл от ЭП по всему пространству дает полное число электронов.
– оператор локальной плотности электрона в точке ri, интегрирование по спиновым переменным эквивалентно суммированию по направлениям спинов, суммирование по электронам вследствие их неразличимости заменено умножением на N. ЭП есть средняя по межэлектронным взаимодействиям плотность N электронов в основном состоянии. Она зависит только от координат рассматриваемых точек пространства r (тогда как волновая функция зависит от координат и спинов всех электронов). Интеграл от ЭП по всему пространству дает полное число электронов.
Электронный спектр – набор спектральных линий, отвечающих разрешенным правилами отбора типам электронных переходов.
Электроотрицательность – индекс реакционной способности, используется наряду с жесткостью и поляризуемостью атомов, ионов, молекул. Первоначально электроотрицательность (c) была представлена Р. Полингом как характеристика относительной способности атома в молекуле притягивать к себе электроны (аттрактор). Определяется как
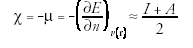
где Е-полная энергия, n-число электронов, I-потенциал ионизации, А-сродство к электрону, m и ν (r) - химический и внешний потенциалы, соответственно. Различие в электроотрицательности - главная причина перемещения электронов в химических реакциях. Если электроны, переданы от реагента с более низкой электроотрицательностью к реагенту с более высокой электроотрицательностью, значения электроотрицательности у этих двух реагентов станут равными. В пределах молекулы, все составляющие атомы имеют одинаковое значение электроотрицательности, которое приближенно равно геометрическому среднему электроотрицательностей изолированных атомов.
Энергия активации (энергетический барьер) - энергия, необходимая для прохождения реакции. Требуется для формирования переходного состояния. Рассчитывается как разность между низшими энергетическими уровнями переходного состояния и реагентов (Ео) с учетом температурной поправки и энергии нулевых колебаний.
Энергия нулевая -остаточная энергия гармонического осциллятора в основном (самом низком по энергии) колебательном состоянии. Существование нулевой энергии является результатом факта, что положение и импульс квантовой частицы не могут быть точно определены одновременно, поэтому ее кинетическая энергия не может быть точно равна нулю.
Энергия промотирования – разность между энергиями состояния атома в молекуле (валентного состояния) и основного состояния изолированного атома.
Энергия стабилизации кристаллическим полем (ЭСКП) – оценивается по отношению к нерасщепленному электронному уровню в поле лигандов сферической симметрии. Чтобы определить ЭСКП, необходимо установить электронную конфигурацию центрального иона в сильном или слабом поле лигандов и подсчитать общую энергию электронов.
Эрмитов оператор -оператор, обладающий свойством 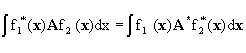 , называется эрмитовым; собственные значения эрмитовых операторов - действительные числа, а их собственные функции образуют полный ортонормированный набор, т.е.
, называется эрмитовым; собственные значения эрмитовых операторов - действительные числа, а их собственные функции образуют полный ортонормированный набор, т.е.
Эффект Яна-Теллера - деформация ядерной конфигурации, понижающая ее симметрию и снимающая вырождение волновой функции для структурно неустойчивых систем, где волновая функция вырождена (например, в случае октаэдрических и плоских комплексов d-элементов). Может иметь как статический, так и динамический характер.
Эффективный заряд атома - полный заряд на атоме qI, вычисляемый как разность qI= ZI - QI , где ZI – заряд ядра атома I, QI - полное число электронов, приписываемое атому I. В приближении Малликена
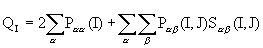 , I<J, a<b.
, I<J, a<b.
Величина Рaa(I) есть электронная заселенность орбитали a, центрированной на атоме I, а 2Рba(I,J)Sba(I,J) - электронная заселенность перекрывания орбиталей a и b, центрированных на атомах I и J. Подход Малликена дает приближенную оценку распределения заряда по молекуле: получаемые величины зависят от используемых при расчете метода и базиса, а деление электронов между атомами без учета их природы неправомочно
«ЕДИНОБОРСТВА ДРЕВНЕЙ РУСИ» (СИСТЕМА)

СИСТЕМА включает в себя:
1. Боевую акробатику
(технику падений, кувырков, перекатов, используемую при перемещениях, уходах и атаках);
2. Технику «системного» удара
(упражнения для постановки ударов руками, «держание» удара);
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 247; Нарушение авторских прав?; Мы поможем в написании вашей работы!