
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вода. Водородная связь
|
|
|
|
Этот удивительный факт пока не нашел однозначного объяснения. Безусловно, вода играет огромную роль в возникновении и существовании жизни на нашей планете. Прежде всего, нужно разобраться, почему вода может находиться в жидком и даже в твердом состоянии (лед) в условиях, в которых похожие соединения водорода с более тяжелыми элементами (серой, селеном и т.д.) газообразны.
Молекула воды имеет следующее строение:

Две поделенные электронные пары участвуют в образовании двух полярных ковалентных связей, а оставшиеся две неподеленные пары электронов тоже играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга. Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре. В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов. Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов.
Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.

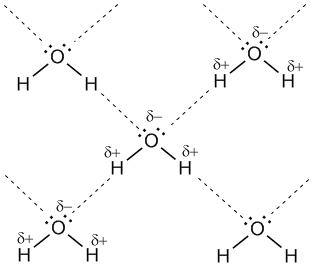
Рис. 7-1а. Водородные связи между молекулами воды (обозначены пунктиром).
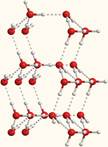
. 7-1б. Объемная модель, показывающая расположение молекул воды, связанных водородными связями.
Энергия водородной связи Н---О в димере воды (H2O)2 составляет 21,5 кДж/моль, а ее длина 2,04 А. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
При температурах выше 0°С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру, как показано на рисунках 7-1а и 7-1б. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед, который имеет примерно такую упорядоченную структуру, как на рис. 7-1б и 3-15 из §3.8.
Кстати, на этих рисунках хорошо видно, что в кристалле льда между молекулами остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности. Большинство же других веществ, при замерзании, увеличивает свою плотность.
Таким образом, водородные связи придают воде еще одно уникальное свойство, без которого вряд ли могла бы существовать разнообразная жизнь в тех районах Земли, где температура зимой понижается ниже 0°С. Если бы лед тонул в воде, то зимой все водоемы промерзали бы до самого дна. Трудно ожидать, что рыбы согласились бы жить в таких условиях. Человек мог бы растапливать лед, превращая его в воду для своих нужд, но это потребовало бы огромных затрат дополнительной энергии.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 544; Нарушение авторских прав?; Мы поможем в написании вашей работы!