
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поверхностные явления
|
|
|
|
Введение. Молекулы, находящиеся во внутренних слоях вещества, испытывают в среднем одинаковое по всем направлениям притяжение со стороны окружающих молекул, молекулы же поверхностного слоя (рис. 193) подвергаются неодинаковому притяжению со стороны внутренних слоев вещества и со стороны, граничащей с поверхностным слоем среды. Так, на поверхности раздела жидкость — воздух молекулы жидкости, находящиеся в поверхностном слое, испытывают большее притяжение со стороны соседних молекул внутренних слоев жидкости, чем со стороны молекул газа. Поэтому свойства поверхностных слоев вещества всегда несколько отличаются от свойств его внутренних частей. Поверхностные свойства оказывают влияние и на другие свойства вещества. Для веществ, поверхность которых сравнительно невелика, эти влияния проявляются слабо. Но по мере увеличения поверхности, происходящего вследствие повышения степени дисперсности (степени раздробленности) вещества, или увеличения его пористости влияние поверхностных свойств начинает проявляться все сильнее и становится значительным для веществ, обладающих сильно развитой поверхностью.
При дроблении вещества суммарная поверхность его частиц увеличивается весьма значительно. В таблице 63 приведены результаты подсчета общей поверхности частиц, получаемых при дроблении кубика вещества с длиной ребра в 1 см на кубики меньших размеров. Так, при дроблении на кубики с длиной ребра 10-7 см (частицы таких размеров встречаются в некоторых коллоидных системах) эта поверхность равняется 6000м2, т. е. 0,6га. В той или иной степени особенности свойств поверхностных слоев вещества проявляются на любой поверхности раздела между двумя фазами. В однокомпонентных системах они наблюдаются на поверхностях раздела жидкость — пар, твердое тело — пар, слабее на границе раздела твердое тело — жидкость и, наконец, еще более слабо — на границе раздела между различными кристаллическими модификациями.
В однокомпонентных системах эти особенности обусловлены в основном разной концентрацией вещества в различных фазах и в некоторых случаях более или менее закономерной ориентацией молекул в поверхностном слое. В системах же, содержащих более одного компонента, и состав поверхностных слоев отличается от состава внутренних частей фаз.
Поверхностное натяжение. Указанные особенности условий существования молекул поверхностного слоя приводят к тому, что увеличение поверхности требует затраты работы. Величина этой работы, отнесенная к 1 см2 поверхности, получила название поверхностного натяжения.
Как известно, если какое-нибудь количество жидкости поместить в среду другой жидкости, не смешивающейся с ней и одинакового с ней удельного веса (чтобы исключить искажающее влияние силы тяжести), то жидкость принимает форму шара под действием сил поверхностного натяжения, всегда вызывающих уменьшение поверхности. Чем меньше количество взятой жидкости, тем сильнее проявляется этот эффект, потому что при уменьшении размеров шара объем его, а следовательно и масса, уменьшаются в большей степени, чем поверхность. (Объем шара пропорционален третьей степени радиуса, а поверхность — только его второй степени.) Капли жидкости достаточно малых размеров приобретают шарообразную форму даже в среде газа, например, капли дождя или тумана.
Поверхностное натяжение будем обозначать через σ; его выражают в динах на см или в эргах на см2, что численно совпадает. Таким образом, поверхностное натяжение можно выражать как силу на единицу длины или как энергию на единицу поверхности. Поверхностное натяжение представляет не полную энергию поверхности, а равно максимальной полезной работе, затрачиваемой на образование единицы поверхности, т. е. представляет собой удельную (на 1 см2) энергию Гиббса поверхности.
Классическим определением энергии Гиббса является выражение
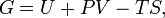
где 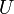 — внутренняя энергия,
— внутренняя энергия, 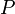 — давление,
— давление,  — объем,
— объем, 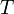 — абсолютная температура,
— абсолютная температура,
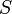 — энтропия.
— энтропия.
Понятие энтропии было впервые введено в 1865году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение общего количества тепла 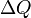 к величине абсолютной температуры
к величине абсолютной температуры 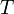 (то есть тепло, переданное системе, при постоянной температуре):
(то есть тепло, переданное системе, при постоянной температуре):
 .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся изменением тепла, вследствие изменения структуры.
Рудольф Клаузиус дал величине 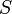 имя «энтропия», происходящее от греческого слова τρoπή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
имя «энтропия», происходящее от греческого слова τρoπή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
Так, 1 мл жидкости в состоянии шарообразных капель диаметром 100 А обладает поверхностью 6-106 см2. Для воды при 20° С (при σ = 72,58 эрг/см2) энергия Гиббса поверхности в этих условиях равна 4,4-108 эрг/г, т. е. 189 кал/моль, а полная энергия поверхности равна 300 кал/моль.
Поверхностное натяжение различных жидкостей неодинаково, так как оно зависит от их мольного объема, полярности молекул, способности молекул к образованию водородной связи между собой и пр. Следует обратить внимание на большую величину поверхностного натяжения воды по сравнению с другими обычными жидкостями. Еще выше поверхностное натяжение расплавленных солей и металлов (см., например, поверхностное натяжение ртути).
Поверхностная ориентация молекул. Молекулы, находящиеся в поверхностном слое жидкости, испытывают неодинаковое воздействие со стороны внутренних слоев жидкости и со стороны смежной фазы. В случае несимметричных молекул некоторая закономерная ориентировка их в пространстве может приводить к меньшему поверхностному натяжению, т. е. быть преимущественной перед другими.
Молекулы высокомолекулярных жирных спиртов или кислот обладают сильно полярными гидроксильной или карбоксильной группами в одной части молекулы и совсем неполярными углеводородными группами в другой. В растворах этих веществ в полярном растворителе, например в воде, молекулы их, находящиеся в поверхностном слое — на границе раздела растворителя с неполярной средой (воздухом, другим газом или неполярным растворителем),— обнаруживают способность к упорядоченному расположению. Они располагаются преимущественно так, что полярные концы их направлены в среду полярного растворителя, а неполярные— в сторону воздуха. Тепловое движение молекул препятствует полной упорядоченности их расположения. Однако при повышении концентрации молекул в поверхностном слое; когда расстояние между ними становится достаточно малым, они могут образовать на поверхности мономолекулярный слой правильно ориентированных молекул (рис. 198). Повышение температуры, естественно, ослабляет ориентацию.
Поверхностная ориентация существенно влияет на многие свойства поверхности и, в частности, повышает механическую прочность пены. Последнее явление широко используется в флотационных процессах.
Флотацией называется метод обогащения и разделения руд путем обработки их в тонкоизмельченном состоянии водой, к которой прибавлено небольшое количество специальных реагентов. Обогащение основано на том, что частицы руд (например, сульфидов металлов) являются гидрофобными, а частицы породы (силикатов, карбонатов) — гидрофильными, они хорошо смачиваются водой и тонут, а частицы руд смачиваются плохо.
Если сильно вспенить воду струей воздуха или другим путем, то частицы руды увлекаются поверхностью пузырьков пены и уносятся вместе с пеной в специальный отстойник. В этих процессах нашли широкое применение различные добавки, влияющие на способность к пенообразованню или адсорбирующиеся частицами и изменяющие их смачиваемость.
На поверхности, образующейся между двумя жидкостями, не смешивающимися между собой или обладающими ограниченной взаимной растворимостью, существуют соотношения, аналогичные рассмотренным. Поверхностное натяжение на поверхности раздела между двумя жидкостями обычно значительно меньше, чем на поверхности раздела между жидкостью и газом. И в этом случае действуют силы, стремящиеся уменьшить энергию Гиббса как путем уменьшения поверхности, так и: путем понижения поверхностного натяжения. Такое понижение происходит в результате адсорбции соответствующих компонентов в поверхностном слое. Это имеет место и в системе из двух компонентов, и при растворении в них третьего вещества (рис. 199).
В случае тонкого диспергирования одной жидкости в другой, в особенности в коллоидных системах, в связи с огромным увеличением поверхности все эти явления приобретают большое значение.
Адсорбция на поверхности твердых тел. Твердые тела всегда обладают способностью в той или другой степени поглощать (адсорбировать) из окружающей среды на своей поверхности молекулы, атомы или ионы. Явление поглощения углем растворенных веществ из раствора впервые было открыто и изучено Т. Е. Ловицем (1785). Для понимания явлений, происходящих на поверхности раздела между твердым телом и газом или между твердым телом и жидкостью, в принципе применимы многие из рассуждений, приведенных в предыдущих параграфах. Адсорбция газа или растворенного вещества на поверхности твердого тела (адсорбента) является процессом, протекающим самопроизвольно, когда адсорбция уменьшает энергию Гиббса поверхности. Иначе говоря, на поверхности адсорбента адсорбируются вещества, понижающие поверхностное натяжение его относительно окружающей среды.
Во многих системах, как показал В. К. Семенченко, на поверхности раздела двух фаз асдорбируются преимущественно те вещества, которые по своей полярности занимают промежуточное место между веществами, образующими эти фазы. Так, спирт хорошо адсорбируется на поверхности раздела вода — воздух и слабо на поверхности раздела металл — вода. Наоборот, ионы солей адсорбируются на металлах, но не адсорбируются на поверхности раздела вода — воздух.
Очевидно, что при прочих одинаковых условиях для данного адсорбирующего тела и данного адсорбируемого газа количество адсорбируемого вещества будет возрастать по мере увеличения адсорбирующей поверхности. Таким образом, для того чтобы достигнуть большого адсорбционного эффекта, необходимо иметь возможно большую поверхность адсорбента. Хорошими адсорбентами могут быть поэтому только такие материалы, которые обладают сильно развитой поверхностью, что свойственно или веществам, имеющим сильно пористую, губчатую структуру, или веществам, находящимся в состоянии тонкого измельчения (высокодисперсным).
Из применяемых на практике адсорбентов первое место принадлежит различным видам специально изготовляемых адсорбционных углей (древесный, кровяной, костяной и др.). Они могут обладать исключительно развитой пористостью и, следовательно, огромной поверхностью пор. Так, 1 г хорошо адсорбирующего угля (активного, или активированного угля) обладает внутренней поверхностью пор, достигающей 400—900 м2. Наряду с общим развитием пористрсти для адсорбционных процессов весьма существенен и характер пористости, т. е. соотношение между количеством пор того или другого сечения. В работах М. М. Дубинина с сотр. были разработаны методы исследования тонкой структуры пор адсорбентов и показано большое значение ее для их адсорбционной способности в различных условиях.
Кроме активных углей, в качестве адсорбентов применяются для различных целей также и некоторые другие вещества, большей частью сильно пористые или высокодисперсные, как, например, гель кремневой кислоты (силикагелъ), глинозем, каолин, некоторые алюмосиликаты.
Искусственным путем теперь изготовляют цеолиты, являющиеся хорошими адсорбентами и обладающие порами постоянного размера (4 А, 5 А и др.). Соизмеримость размера пор с размером молекул дает возможность использовать такие цеолиты для разделения компонентов газовых смесей и жидких растворов в зависимости от размеров молекул или ионов этих компонентов. Молекулярные сита, как называют такие адсорбенты, применяются для разделения углеводородов, осушки газов и других целей.
Количество газа или растворенного вещества, адсорбируемое определенным количеством данного адсорбента, зависит и от вида газа или раствора, и от условий протекания процесса, в первую очередь от давления газа или концентрации растворенного вещества, и от температуры. При прочих одинаковых условиях влияние давления или концентрации газа на адсорбируемое количество его может быть изображено кривыми рис. 200, называемыми изотермами адсорбции. Изотермы, представленные на этом рисунке, относятся к адсорбции аммиака на древесном угле по данным А. А. Титова (1910). Наиболее типичной является верхняя кривая рис.200.
Повышение давления газа, как правило, увеличивает адсорбируемое количество его. Однако на разных участках адсорбционной изотермы это влияние сказывается неодинаково. В особенности сильно оно проявляется в области низких давлений, где адсорбируемое количество газа прямо пропорционально его давлению (участок / изотермы).
При дальнейшем повышении давления количество адсорбируемого газа тоже увеличивается, но уже в постепенно уменьшающейся степени (участок // изотермы), и дальше кривая, выражающая эту зависимость, стремится к прямой, параллельной оси абсцисс (участок ///). Это соответствует постепенному насыщению поверхности адсорбента. Когда насыщение достигнуто, дальнейшее повышение давления или концентрации практически уже не влияет на количество адсорбируемого газа.
В узких капиллярах, если жидкость хорошо смачивает их стенки, мениск ее всегда бывает вогнутым. В этом случае давление насыщенного пара будет более низким, чем над плоской поверхностью (см. § 169). В результате пар, еще не достигший давления насыщения по отношению к плоской поверхности, может быть уже насыщенным и даже пересыщенным по отношению к жидкой фазе, находящейся в тонких капиллярах, и конденсироваться в них, постепенно их заполняя. Этот процесс называется капиллярной конденсацией. Многие природные и искусственные материалы (почвы, рыхлые известняки, уголь и др.) обладают сильно развитой системой капилляров и пор; в них способны конденсироваться пары воды или других жидкостей, не являющиеся насыщенными по отношению к обычной плоской поверхности.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 901; Нарушение авторских прав?; Мы поможем в написании вашей работы!