
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оценка степени сродства элементов к кислороду по изменению изобарно-изотермного потенциала образования оксидов
|
|
|
|
О ХИМИЧЕСКОМ СРОДСТВЕ ЭЛЕМЕНТОВ К КИСЛОРОДУ
Реакции восстановления и окисления металлов являются составной частью металлургических процессов. Поэтому для изучения таких реакций нужно знать характеристики, оценивающие прочность связи металла с кислородом.
Изобарно-изотермный потенциал является функцией состояния.
G=H-T*S
Н - энтальпия; Т - термодинамическая температура; S - энтропия тела (системы);
и отражает общую движущую силу процесса, которая складывается из стремления системы к уменьшению энтальпии и возрастанию энтропии. Изменение энергии Гиббса(∆G) - мера химического сродства веществ, взятых в данных соотношениях, при данных условиях.
Рассчитав ∆Gпроцесса, можно сделать вывод о возможности протекания процесса в прямом направлении. Самопроизвольное течение процессов возможно при условии убыли в них изобарно-изотермного потенциала (энергии Гиббса), то есть ∆ G <0.
При наличии в системе газовой фазы кислорода направление протекания процессов определяется изменением изобарно-изотермного потенциала DG. На рис. 91 приведены кривые, построенные по результатам определения изобарно-изотермного потенциала образования некоторых оксидов в зависимости от температуры:
- если в данной реакции изобарный потенциал уменьшается, процесс самопроизвольно развивается в направлении окисления;
- если этот потенциал растет,— самопроизвольное окисление невозможно;
- наконец, значение изобарного потенциала, равное нулю, отвечает равновесному состоянию реакции.
Нетрудно видеть, что чем больше по своему значению убыль DG при образовании данного оксида, тем выше сродство элемента к кислородув этом оксиде.
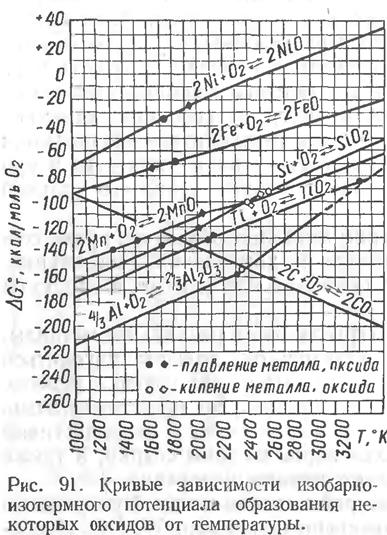
Из графиков вытекает следующее:
1. В интервале 1000—3500 °К изобарно-изотермный потенциал образования оксидов с повышением температуры увеличивается, что говорит об уменьшении степени сродства элементов к кислороду с ростом температуры (окисление затормаживается). Исключение составляет реакция образования окиси углерода.
2. По убывающей силе сродства к кислороду при температуре 3500 °К рассмотренные элементы можно расположить в такой ряд: С; Ti; Al; Mn; Si; Fe; Ni.
Интересна зависимость от температуры сродства углерода к кислороду: при относительно низких температурах (1000 ºС), близких к началу затвердевания сталей, углерод как раскислитель смещается с первого на пятое место в указанном ряду, уступая в сродстве к кислороду алюминию, титану, кремнию и марганцу.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 1390; Нарушение авторских прав?; Мы поможем в написании вашей работы!