
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль 3
|
|
|
|
Химиялық процестердің энергетикасы. Химиялық кинетика
101. 4NH3 +3O2 ↔ 2N2 +6H2O реакциясында оттектің концентрациясын 3 есе арттырғанда реакция жылдамдығы:
1. 27 есе артады;
2. 3 есе артады;
3. 9 есе артады;
4. 6 есе артады;
5. 27 есе кемиді.
102. Температураны 500С-тан 900С-ға көтергендегі (γ=2) реакция жылдамдығының артуы:
1. 16 есе;
2. 12 есе;
3. 4 есе;
4. 8 есе;
5. 10 есе.
103. Реакция жылдамдығын тездетіп, бірақ өздері реакцияға қатыспайтын заттар –
1. катализаторлар;
2. ингибиторлар;
3. изотоптар;
4. депрессаторлар;
5. гидраттар.
104. Арасында гомогенді реакция жүретін жағдай:
1. хлор мен сутек;
2. сутек пен натрий;
3. фтор мен натрий;
4. күкірт пен хлор;
5. оттек пен натрий.
105. 2SO3 ↔ 2SO2+O2-198 кДж термохимиялық теңдеуі бойынша 8 г күкірт (ҮІ) оксиді ыдырау кезіндегі сіңірілетін жылу:
1. 9,9 кДж;
2. 99 кДж;
3. 19,8 кДж;
4. 124 кДж;
5. 12,4 кДж.
106. Гомогенді реакция жүретін орта:
1. Г+Г;
2. Г+С;
3. Г+С+Қ;
4. Г+Қ
5. С+Қ.
107. Оттектің концентрациясын 2 есе арттырғанда күкіртсутектің жану реакциясының 2H2S+3O2 ↔ 2SO2+2H2O жылдамдығы:
1. 8 есе артады;
2.;8 есе кемиді
3. 6 есе артады;
4. 6 есе кемиді;
5. 2 есе артады.
108. N2+O2 ↔ 2NO–180кДж теңдеу бойынша 45 кДж жылу сіңірілу үшін азоттың қандай көлемі (қ.ж.) әрекеттесу керек?
1. 5,6 л;
2. 11,2 л;
3. 11,2 мл;
4. 5,6 мл;
5. 22,4 л.
109. Химиялық реакциялардың жылдамдығына қандай факторлар әсер етпейді?
1. жүйенің қысымы;
2. әрекеттесүші заттар табиғаты;
3. әрекеттесүші заттар концентрациясы;
4. температура;
5. катализаторлар.
110. N2 +3H2 ↔ 2NH3 +90кДж термохимиялық теңдеуі бойынша 450 кДж жылу бөлінген болса, сутектің (қ.ж.) көлемін анықтаңыз.
1. 336 л
2. 672 л
3. 67,2 л
4. 33,6 л
5. 224 л
111. Берілген реакциялардың ішіндегі ең жылдамы:
1. май шамның жануы;
2. тиынның қараюы;
3. жапырақтың сарғаюы;
4. сүттің ашуы;
5. темірдің таттануы.
112. 2SO2(г) +O2(г) ↔ 2SO3(г)+ Q үрдісінің сипаты:
1. қосылу және гомогенді;
2. айырылу және экзотермиялық;
3. қайтымсыз және экзотермиялық;
4. гомогенді және қайтымсыз;
5. қосылу және эндотермиялық.
113. Арасында экзотермиялық реакция жүретін жағдай:
1. 3Fe+2O2 → Fe3O4;
2. 2H2O → 2H2 +O2;
3. 4HNO3 → 4NO2+O2 +2H2O.;
4. CaCO3 → CaO+CO2;
5. Cu(OH)2 →CuO + H2O
114. 2NO + O2 ↔ 2NO2 реакциясында азот (ІІ) оксидінің концентрациясын 4 есе азайтса, реакция жылдамдығы:
1. 16 есе кемиді;
2. 16 есе артады;
3. 8 есе кемиді;
4. 8 есе артады;
5. 2 есе артады.
115. 2Fe(к) +3Cl2(г) ↔ 2FeCl3 реакциясының кинетикалық теңдеуі:
1. v= kC3Cl2;
2. v=kC2Fe;
3. v=kC2FeC3Cl2C2FeCl3;
4. v= kC2FeCl3;
5. v=kC2FeC3Cl2.
116. 2SO2(r)+O2(r) ↔ 2SO3(r) реакциясының жылдамдығы жүйенің қысымын 2 есе төмендеткенде:
1. 8 есе кемиді;
2. 8 есе артады;
3. 4 есе кемиді;
4. 4 есе артады;
5. 2 есе кемиді.
117. Температура 300С-ға төмендеп, жылдамдық 27 есе азайғанда, температуралық коэффициент:
1. 3;
2. 2;
3. 2,5;
4. 3,5;
5. 4.
118. Вант-Гофф ережесі бойынша химиялық реакция жылдамдығы 2-4 есе өседі:
1. температура 100С-ға жоғарылып турса;
2. температура 200С-ға жоғарылып турса;
3. температура 300С-ға жоғарылып турса;
4. температура 100С-ға төмендеп турса;
5. температура 200С-ға төмендеп турса.
119. Химиялық реакция жылдамдығының өлшем бірлігі:
1. моль/л∙с;
2. моль/л;
3. моль/с;
4. л/с;
5. кДж/моль.
120. С(к)+ О2(г)Û СО2(г)+ 412 кДж термохимиялық теңдеуді ескере тұрып, 206 кДж жылу бөліну үшін қанша көмір жағу керек:
1. 6 г;
2. 12 г;
3. 12 кг;
4. 6 кг;
5. 10 кг.
121. Сутектің концентрациясын 3 есе төмендеткенде мына теңдеуде H2+Cl2= 2HCl қандай өзгерістер болу мүмкін?
1. реакция жылдамдығы 3 есе кемиді;
2. реакция жылдамдығы 6 есе кемиді;
3. реакция жылдамдығы 9 есе кемиді;
4. реакция жылдамдығы 3 есе артады;
5. реакция жылдамдығы 6 есе артады.
122. С(к)+ О2(г)Û СО2(г) реакцияның кинетикалық теңдеуі:
1. v= kCО2;
2. v=kCС;
3. v=kCСCО2;
4. v= kC2C;
5. v=kC2СC3О2.
123. 2Н2+О2=2Н2О теңдеуімен жүретін реакцияда сутектің концентрациясын 3 есе арттырса жылдамдық қалай өзгереді?
1. 9;
2. 6;
3. 4;
4. 2;
5. 3.
124. 4NH3 + 5O2 = 4NO + 6H2O теңдеуімен жүретін реакция жылдамдығының математикалық формуласы қалай жазылады?
1. υ = k[NH3]4[O2]5;
2. υ = k[NH3][O2];
3. υ = k[NO]4[H2O]6;
4. υ = k[O2]5;
5. υ = k[NH3]4.
125. 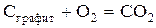 теңдеуімен жүретін реакция үшін әсер етуші массалар заңы қалай жазылады?
теңдеуімен жүретін реакция үшін әсер етуші массалар заңы қалай жазылады?
1. υ = k[O2];
2. υ = k[C][O2];
3. υ = k[CO2];
4. υ = k[C];
5. υ = [C][O2].
126. 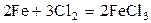 теңдеуiмен өтетiн реакцияда қысымды 3 есе арттырса, жылдамдығы қалай өзгередi?
теңдеуiмен өтетiн реакцияда қысымды 3 есе арттырса, жылдамдығы қалай өзгередi?
1. 27;
2. 9;
3. 3;
4. 162;
5. 54.
127. Температураëық коэффициентi 2-ге тең реакцияның температурасын 40°С арттырса, жылдамдық неше есе өседi?
1. 16;
2. 4;
3. 6;
4. 8;
5. 2.
128. Температураны 50°С арттырғанда реакцияның жылдамдығы 243 есе артқан болса, температуралық коэффициентi неге тең?
1. 3;
2. 1;
3. 2;
4. 4;
5. 5.
129. С(қ)+Н2О(бу)= СО(г)+Н2(г) теңдеуімен берілген реакцияның жылдамдығы қай заттың концентрациясымен анықталады?
1. [Н2О];
2. [С];
3. [С] және [Н2О];
4. [СО];
5. [Н2].
130. Температуралық коэффициенті 3-ке тең реакцияның температурасын 40°-тан 70°Ñ көтергенде жылдамдығы неше есе артады?
1. 27;
2. 3;
3. 9;
4. 36;
5. 40.
131. Теңдеуі S+O2 Û SO2 химиялық реакциясының жылдамдығ қай формуламен өрнектеледі?
1. 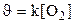 ;
;
2. 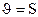 ;
;
3. 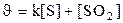 ;
;
4. 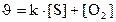 ;
;
5. 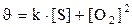 .
.
132. Теңдеуі 2ÑÎ+Î2=2ÑÎ2 реакциясында әрекеттесуші заттардың концентрациясын 2 есе арттырса жылдамдық неше есе артады?
1. 8;
2. 4;
3. 2;
4. 6;
5. 10.
133. Òåңäåói N2+O2=2NO ðåàêöèÿíûң æûëäàìäûғûí қàíäàé ôîðìóëàìåí àíûқòàéäû?
1. 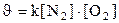 ;
;
2. 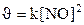 ;
;
3. 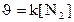 ;
;
4. 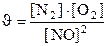 ;
;
5. 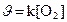 .
.
Химиялық тепе-теңдік
134. CO(r)+2H2(r) ↔ CH3OH(r)+Q үрдісіндегі тепе-теңдікті сол жаққа ығысытыратын жағдай:
1. H2 концентрациясын төмендету;
2. H2 концентрациясын арттыру;
3. CO концентрациясын арттыру;
4. CH3OH концентрациясын төмендету;
5. температураны төмендету.
135. Мына жүйеде FeO(қ) + H2(г) ↔ Fe(қ)+H2O(г)-Q химиялық тепе-теңдік реакция өніміне қарай жылжиді, егер:
1. температура жоғарыласа;
2. температура төмендесе;
3. қысым жоғарыласа;
4. қысым төмендесе;
5. FeO концентрациясын азайтса.
136. H2(r)+Cl2(r) ↔ 2HCl(r)+Q үрдісте тепе-теңдік ығыспайтын жағдай:
1. қысымның артуы;
2. температураның кемуі;
3. температураның артуы;
4. Н2 концентрациясының артуы;
5. Н2 концентрациясының кемуі
137. 2NO(r)+O2(r) ↔ 2NO2(r)+Q реакциясында тепе-теңдікті оңға ығыстыратын жағдай:
1. температураны төмендету;
2. қысымды төмендету;
3. температураны арттыру;
4. NO концентрациясын төмендету;
5. O2.концентрациясын төмендету
138. Қандай фактор мына процестің 2SO2(г)+ O2(г) ↔ 2SO3(г)+ Q тепе-теңдігін оңға қарай ығыстырады?
1. қысымның өсуі;
2. бастапқы заттардың концентрациясының кемуі;
3. катализатордың табиғатының өзгеруі;
4. температураның өсуі;
5. өнімдердің концентрациясының өсуі.
139. Мына жүйеге N2+O2 ↔ 2NO–180кДж катализаторлар қосқан кезде тепе-теңдік қалай ығысады?
1. ығыспайды;
2. оңға;
3. солға;
4. алдымен оңға, содан кейін солға;
5. алдымен солға, содан кейін оңға.
140. 2NH3(r)+Q ↔ N2(r) +3H2(r) үрдістегі тепе-теңдікті солға ығыстыратын жағдай:
1. температураны төмендету;
2. қысымды төмендету;
3. температураны жоғарылату;
4. катализатор қосу;
5. Н2 концентрациясын арттыру.
141. Қандай факторлардың әсер етуімен мына тепе-теңдікті СО2(г) + Н2О(с) Û Н2СО3(с) + Q оңға қарай ығыстыруға болады?
1. қысымның өсуімен;
2. температураның өсуімен;
3. араластырумен;
4. қысымның төмеңдеуімен;
5. катализатор қосуымен.
142. Арасында қайтымсыз реакция жүретін жағдай:
1. мырыш пен мыс сульфаты;
2. азот пен сутек;
3. сутек пен оттек;
4. күкірт (ІҮ) оксиді және оттек;
5. азот оксиді (ІІ) және оттек.
143. Қай процеске тепе-теңдiк күйі тән?
1. күмiс нитраты+натрий хлоридi;
2. кальций карбонаты+тұз қышқылы;
3. аммиак синтезi;
4. барий сульфатын тұнбаға түсiру;
5. бейтараптану реакциясы.
144. Экзотермиялық реакцияның тепе-теңдiгi қыздырғанда қай жаққа ығысады?
1. солға;
2. ығыспайды;
3. оңға;
4. реакция жүрмейдi;
5. жартылай ығысады.
145. Қайтымды процесте қай параметрдiң өзгеруi процестiң тепе-теңдiгiн ығыстырмайды?
1. катализатор;
2. бастапқы заттар концентрациясы;
3. температура;
4. өнiмдер концентрациясы;
5. қысым.
146. Газ күйіндегі заттардың арасындағы реакция теңдеуі А+2В=2С болса, қысымды арттырғанда тепе-теңдік қай бағытқы ығысады?
1. солдан оңға;
2. оңнан солға;
3. ығыспайды;
4. бастапқы заттар жағына;
5. молекула саны көп жағына.
147. Температураны арттырғанда экзотермиялық қайтымды реакцияның тепе-теңдігі қай бағытқа ығысады?
1. оңнан солға;
2. солдан оңға;
3. ығыспайды;
4. тура реакция жағына;
5. экзотермиялық реакция жағына.
148. Қайтымды реакцияның тепе-теңдігіне катализаторлардың әсері қандай?
1. ығыстырмайды;
2. тепе-теңдікті солға ығыстырады;
3. тепе-теңдікті оңға ығысытрады;
4. кері реакция жағына ығыстырады;
5. тепе-теңдікке әсер етпейді.
149. Төмендегі теңдеулермен көрсетілген қайтымды реакцияның қайсысында қысым кемігенде тепе-теңдік ығысады?
1. 2H2+O2 Û 2H2O(Б);
2. N2+O2 Û 2NO;
3. H2 + J2 = 2HJ;
4. 2HBr Û H2+Br2;
5. CO2+H2 Û CO+H2O(Б).
150. 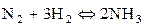 +Q теңдеуімен берілген реакцияның температурасын өсіргенде тепе-теңдік қай бағытқа ығысады?
+Q теңдеуімен берілген реакцияның температурасын өсіргенде тепе-теңдік қай бағытқа ығысады?
1. оңнан солға;
2. солдан оңға;
3. ығыспайды;
4. экзотермиялық реакция жағына;
5. тура реакция жағына.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 4068; Нарушение авторских прав?; Мы поможем в написании вашей работы!