
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 50
|
|
|
|
Наблюдения Резерфорда за рассеиванием α-частиц привели его к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома.
Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны.
Планетарная модель атома оказалась неспособной объяснить сам факт длительного существования атома, то есть его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10-8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро.
Первым признал невозможность применения законов классической физики к атомам датский ученый Нильс Бор.
Для решения противоречий Бор, сохраняя классический подход к описанию поведения электрона в атоме, выдвинул три постулата, которые называются постулатами Бора.
Первый постулат (постулат стационарных состояний): существуют стационарные состояния атома, находясь в которых он не излучает энергии.
Второй постулат (правило частот): при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.
Атомы излучают и поглощают энергию порциями — квантами, значение которых 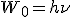 равно разности энергии тех стационарных состояний, между которыми происходит данный переход, т.е.
равно разности энергии тех стационарных состояний, между которыми происходит данный переход, т.е.

Третий постулат (правило квантования орбит): в стационарном состоянии атома электрон, движущийся по круговой орбите, должен иметь квантованные (дискретные) значения момента импульса, которые удовлетворяют условию
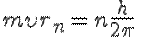 ,
,
где m — масса электрона, 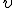 — скорость электрона на n-й орбите, rn — радиус стационарной орбиты, n = 1, 2, 3,... — номер орбиты электрона.
— скорость электрона на n-й орбите, rn — радиус стационарной орбиты, n = 1, 2, 3,... — номер орбиты электрона.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 250; Нарушение авторских прав?; Мы поможем в написании вашей работы!