
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Kb – негіздік иондану константасы. 1 страница
|
|
|
|
ВЫВОД
В данном курсовом проекте мы рассчитали следующие величины:
1) Гидростатические кривые
2) Остойчивость на больших углах крена
3) Остойчивость по правилам Регистра
4) Остойчивость при затоплении отсека
В первом разделе мы определили зависимости площадей погруженных частей шпангоутов от осадки. По этим данным построили чертеж «Масштаб Бонжана». По масштабу Бонжана можно вычислить водоизмещение V и абциссу Xc.
Во втором разделе были вычислены элементы теоретического чертежа:
Площадь ватерлинии; Абсцисса центра тяжести площади ватерлинии; Объемное водоизмещение; Абсцисса центра величины; Момент инерции площади ватерлинии относительно продольной оси Ох; Момент инерции площади ватерлинии относительно поперечной оси; Начальный поперечный метацентрический радиус; Начальный продольный метацентрический радиус; Аппликата метацентра; Коэффициент общей полноты; Коэффициент полноты площади ватерлинии; Коэффициент полноты площади мидель-шпангоута;
По этим значениям были построены соответствующие графики.
В третьем разделе мы определили остойчивость на больших углах крена. Были построены диаграммы статической и динамической остойчивости. Диаграмма статической остойчивости - это зависимость восстанавливающего момента mb и плеча восстанавливающего момента 1тета от угла крена судна. Диаграмма динамической остойчивости - это зависимость работы восстанавливающего момента Ав и плеча динамической остойчивости Id от угла крена судна.
В четвертом разделе курсового проекта рассчитаны критерии погоды по правилам Регистра 1999 года. Оба этих критерия выполняются, следовательно, судно способно противостоять одновременному действию динамически приложенного давления ветра и бортовой качки. Остальные требования "Правил классификации и постройки морских судов" тоже выполняются.
|
|
|
В пятом разделе были вычислены необходимые параметры для диаграммы Благовещенского. Диаграмма Благовещенского показывает изменения осадок носом eн, кормой eк и в центре тяжести объема затопленного отсека eр при затоплении некоторого условного отсека. Поперечная начальная метацентрическая высота после затопления отсека стала больше, чем начальная поперечная метацентрическая высота. Из этого следует, что поперечная остойчивость судна после затопления отсека увеличилась.
Литература
1. Семенов-Тян-Шанский В. В. Статика и динамика корабля. Учебник для вузов. – л.:Судостроение. 1973. – 608 стр.
2. Справочник по теории корабля: В трех томах. Том 2. Статика судов. Качка судов./под редакцией. Я. И. Войткунского. – Л.: Судостроение, 1985.-440 стр.
3. Статика корабля: учебник/ Рождественский В. В., Луговский В. В., Борисов Р. В., Мирохин Б. В..- Л.; Судостроение, 1986.-240 стр.
4. Благовещенский С. Н., Холодилин А. Н., Справочник по статике и динамике корабля. В двух томах. Изд. 2-е, переработанное и дополненное. Том 1. статика корабля. – Л.: Судостроение. 1973.-335 стр.
5. Правила классификации и постройки морских судов. 1995. Российский Морской Регистр судоходства. Том 1. – СПб.: Транспорт. 1995. –458 с.
[OH-] = √Kb.Cb
pOH = -lg[OH-] = - ½ lgKb – ½ lgCb = ½ pKb - ½ lgCb
ал pH = pKw – pH = 14 - ½ pKb + ½ lg Cb
Көп протонды қышқылдар мен негіздер сатылап ионданады, бірақ бірінші сатысының иондану процесі басқа сатыларына қарағанда бірнеше есе жоғары дәрежеде жүреді. Егер Ka1/Ka2 ≥1000 болса, мұндай қышқылдарды бір протонды қышқыл деп қарастыруға болады. Сонда
pH = ½ pKa1 – ½ lg CHA
Егер әлсіз қышқылдар ерітіндісі өте сұйытылған болса, немесе қышқылдық (негіздік) константалардың мәндері үлкен болса, рН мәнін есептеу күрделенеді.
|
|
|
11. Вольтамперметрлік талдау әдісі. Полярография әдісін сапалық және сандық талдауда қолдану. Шекті диффузиялық ток пен жартылай толқын потенциалы нені анықтауда қолданылады?
Вольтамперометрлік әдістер поляризацияланбайтын салыстырмалы электрод пен поляризацияланатын индикаторлы электродтарға берілген кернеу мен электролиттік ұяшық арқылы өтетін электр тоғының тәуелдігін қарастыратын әдістер.
Индикаторлы электрод ретінде тамшылы снап электродын (т.с.э.) қолданғанда, әдіс полярография деп аталады. Индикаторлы электрод ретінде басқа электродтар (платина, графит, шыны-көміртек) қолданғанда, әдіс вольтамперометрия деп аталады. Бұл әдістер ток табиғатына байланысты классикалық полярография, ауыспалы-токты полярография, импульсті полярография, инверсионды вольтамперометрия, импульсті вольтамперометрия, тура вольтамперометрия және т.б. деп бөлінеді. Салыстырмалы электродтардың потенциалдары электр тізбегіне жіберілген ток күшіне тәуелсіз әрқашанда тұрақты болады, сондықтан олар поляризацияланбайтын электродтарға жатады.
Тура вольтамперометрия әдісінде вольтамперограмма тәуелдігін түсіру үшін электр тізбегі құрастырылады: зерттелетін ерітіндіге индикаторлы және салыстырмалы электродтар орналыстырылып, өзгеріп тұратын кернеу беріледі. Графикте абсцисса осінде индикаторлы электродының потенциал шамасы, ал ординатада – сол потенциалға сәйкес өзгеріп отырған ток шамасы белгіленеді. Алынған тәуелділік вольтамперометрлік қысығы немесе вольтамперограмма деп аталады.
Вольтамперграммалардың кез келген нүктесіндегі ток шамасы мен электрод потенциалы арасындағы байланыс келесі теңдеумен сипатталады:

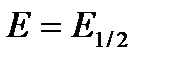 -
- 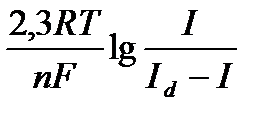
Мұнда Е1/2 - жартылай ток потенциалы
n – электрондар саны
I – кез келген нүктедегі ток шамасы
Id - шекті диффузиялық ток шамасы
Шекті диффузиялық ток төмендегі Левич теңдеумен анықталады
Id = 0,62 n FSD2/3ω1/2 ν1/6c
Мұнда S – индикаторлық электрод ауданы
|
|
|
D – деполяризатордың диффузия коэффициенті
ω – электродтың бұрыштық айналу жылдамдығы
ν – зерттелінетін ерітіндінің кинетикалық тұтқырлығы
c – деполяризатор концентрациясы, моль/л
Вольтамперометрлік қисықтарды бірдей жағдайларда түсіруде концентрациядан басқа барлық параметрлері тұрақты және бірдей болатындықтан, жоғарыда берілген теңдеу келесі түрге айналады:
Id = Kc
Мұнда К – тұрақты шама.
Классикалық полярография
Полярографиялық талдау тәсілі аналитикалық мақсаттарды орындау үшін ток күшімен сырттан берілген кернеу арасындағы байланысты пайдаланады. Өлшеуді арнайы прибор – полярографта орындайды. Поларография әдісінің артықшылығы – жоғары сезгіштілігі (10-5 – 10-6 моль/л), жақсы талғағыштығы, қайталанымдылығы. Полярографиялық әдісте деполяризатор (тотығатын немесе тотықсызданатын компонент) ерітіндісінің электролизі кезіндегі индикаторлы электрод (т.с.э.) потенциалы мен ток күші арасындағы тәуелділік қисығы полярограмма деп аталады. Полярограмма толқын тәріздес болады, сондықтан оны полярографиялық толқын деп атайды. Тамшылы снап электроды снап құйылған резервуардан және онымен шланг арқылы қосылған капиллярдан тұрады. Снап белгілі жиілікпен зерттелетін ерітіндіге тамшылап тұрады, сол себептен электрод беті үнемі жаңарады. Мысал ретінде тамшылы снап электродында кадмий иондарының тотықсыздануын қарастырайық
Cd2+ + 2e = Cd(Hg)
Тотықсызданған кадмий снапта еріп амальгама Cd(Hg) түзеді.
Полярографиялық толқын сапалық және сандық сипаттама береді. Толқынның жоғары көлденең бөлігі шектік диффузиялық токқа жетуін көрсетеді (Id). Шекті диффузиялық токтың жартысына сәйкес келетін потенциал жартылай ток потенциалы (E1/2) деп аталады. E1/2 тотығу-тотықсыздану жұптардың стандарт потенциалдарына жақын болып келеді, яғни иондар табиғатымен анықталып, талданатын ерітіндінің сапалық құрамын анықтауға мүмкіндік беретін сапалық сипаттама болып табылады. Зертелінетін жұптың Е1/2 –ын стандарт потенциалымен салыстыра отыра, қандай ион екені туралы қорытынды жасауға болады. Т.с.э. үшін шекті диффузиялық ток шамасының деполяризатор концентрациясына тәуелдігі Левич теңдеуіне ұксас Илькович теңдеуімен өрнектеледі:
|
|
|
Id = 0.627nFD1/2m2/3t1/6c
мұнда Id –шекті диффузиялық ток,мкА
D – электроактивті ионның диффузия коэффициенті
m - снаптың капиллярдан ағу жылдамдығы
t – снаптың тамшылау жиілігі
n – электродтық реакцияға қатысатын электрондар саны
F – Фарадей тұрақтысы
с – деполяризатордың мольдік концентрациясы.
Бірдей жағдайда және бір капиллярмен жұмыс істегенде Илькович теңдеуіне кіретін шамалар тұрақты болады да, ток пен концентрация арасында түзу сызықтық тәуелділік байқалады:
Id = kc.
Сандық полярографиялық талдау осы сызықтық тәуелділікке негізделген.Полярографиялық талдауда көбінесе стандартты ерітінділер бойынша градуирлеу қисығын тұрғызу әдісі, стандартты ерітінділер әдісі немесе үстеме әдісі қолданылады.
1. Градуирлеу әдісі. Алдын ала стандартты ерітінділер дайындап, олардың полярографиялық толқындарын алады, толқын биіктігі – концентрация тәуелділі тұрғызылады. Белгісіз концентрациялы ерітіндінің полярографиялық толқын биіктігін анықтап, график арқылы оның концентрациясы анықталады.
2. Стандартты ерітінділер әдісі. Зерттелетін ерітіндінің шамамен концентрациясы белгілі болса, онда осы концентрацияға жақын стандартты ерітінді дайындайды да, екі ерітіндінің де полярографиялық толқындарын түсіреді. Пропорция құрып белгісіз концентрацияны есептеп анықтайды.
3. Үстеме әдісі. Зерттелетін ерітіндіге стандарт ерітіндісін қосады да полярографиялық толқындарды алады. Жалпы көлемді ескеріп отырып, математикалық есептеу жолымен белгісіз шаманы табады.
12. Тт-тсзд потенциалына тұнба түзілудің және комплексті қосылыстар түзілудің әсері. Мысал келтіріңіз. Потенциалға жүйеде комплексті қосылыс түзілуінің әсері.Тотығу-тотықсыздану жұбының компоненттері қосымша комплекстүзу реакциясына қатысуы потенциалға өте үлкен әсер етеді. Себебі, жүйеде комплекс түзетін заттың активтігі азаяды. Мысалы,
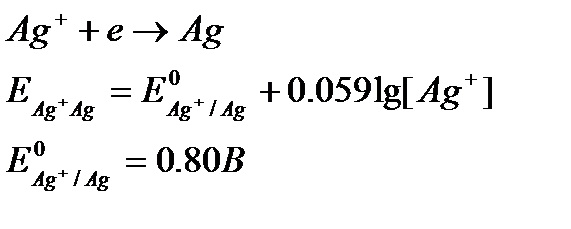
Осы жүйеге KCN ерітіндісін қосқан кезде, күміс иондары цианидты комплекс түзеді:
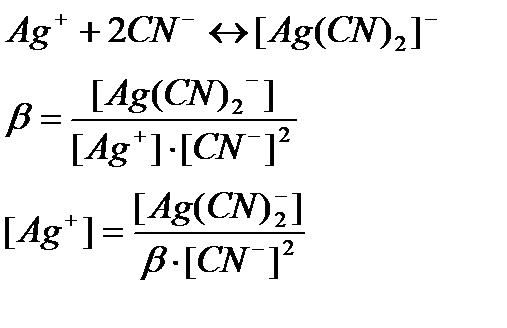

Осыдан бос күйдегі күміс иондарының концентрациясы азайғанын көруге болады. Осы шаманы Нернст теңдеуіне қойып, келесі тәуелділікті аламыз

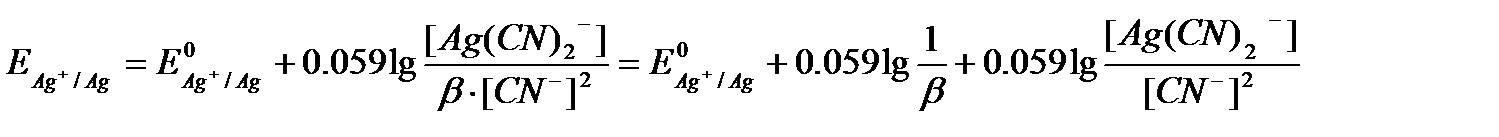
Егер [Ag(CN)2-] =[CN-] = 1 болса 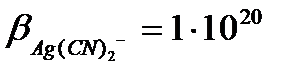
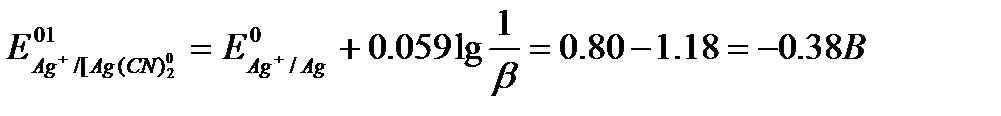
1) Алдында қарастырылған Ag+/Ag жұбына NaCl ерітіндісі қосылатын болса, онда
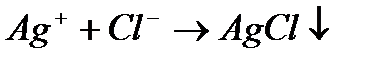
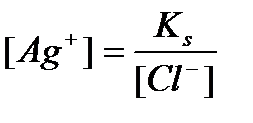
Cол себептен күміс иондарының концентрациясы кемиді, және осы шаманы Нернст теңдеуіне қойсақ, потенциалдың өзгеретінің көруге болады: 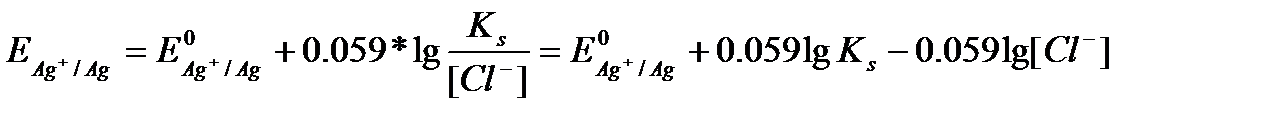 Тт-тсзд жұбының бір компонентімен бәсекелес тұнба түзу реакциясысол компоненттің активтігін азайтып,тт-тсзд потенциалын өзгертеді. Бәсекелес реакцияның әсерін алынған тұнбаның ерігіштік көбейтіндісін пайдаланып ескеруге болады: Е=E0+0,0059lgaAg+. Хлорид иондарын қосқанда AgCl тұнбасы пайда болады: ЕКAgCl= a Ag+* a Cl- =1,78*10-10 Ерігіштік көбейтіндісінің мәнінен a Ag+= ЕКAgCl\ a Cl- мәні Е=E0+0,0059lgЕК\ a Cl-= E0+0,0059lgЕК-0,0059lg a Cl-.
Тт-тсзд жұбының бір компонентімен бәсекелес тұнба түзу реакциясысол компоненттің активтігін азайтып,тт-тсзд потенциалын өзгертеді. Бәсекелес реакцияның әсерін алынған тұнбаның ерігіштік көбейтіндісін пайдаланып ескеруге болады: Е=E0+0,0059lgaAg+. Хлорид иондарын қосқанда AgCl тұнбасы пайда болады: ЕКAgCl= a Ag+* a Cl- =1,78*10-10 Ерігіштік көбейтіндісінің мәнінен a Ag+= ЕКAgCl\ a Cl- мәні Е=E0+0,0059lgЕК\ a Cl-= E0+0,0059lgЕК-0,0059lg a Cl-.
13. Ерігіштік, өлшем бірліктері. Ерігіштік константа түрлері (Кs0) өзара байланыстарын жазыңыз. Ерітінді қаныққанша еру процессінің жылдамдығы тұну процессінің жылдамдығынан жоғары болады, уақыт өткен сайын ол белгілі шамаға дейін төмендейді. Оның шамасы фазалар арасындағы тепе-теңдік константасымен сипатталады
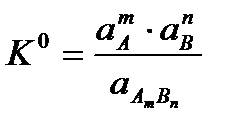
Қатты заттардың активтілігі тұрақты шама болғандықтан
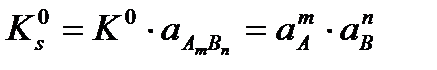
Кs0 – термодинамикалық ерігіштік константасы деп аталады (немесе «ерігіштік көбейтіндісі»). Бұл теңдеуді тұнба еру және тұнба түзілу процесстерінің жылдамдықтары арқылы да шығару болады. Сонымен, нашар еритін күшті электролиттердің қаныққан ерітіндісіндегі иондардың активті концентрацияларының көбейтіндісі белгілі температура мен қысымда тұрақты шама болып табылады. Бұдан келесі қорытынды жасауға болады: нашар еритін күшті электролиттердің қаныққан ерітіндісіндегі жеке иондардың концентрациялары қаншалықты өзгергенімен, олардың көбейтінділерінің шамалары тұрақты болады.
Ерігіштік константасы тұнба түзілу немесе еру жағдайын сипаттайды:
- егер ерітіндіде иондардың көбейтіндісі (ИК) ерігіштік константасынан төмен болса ИК˂Кs0 жүйе қанықпаған болады да тұнба түзілмейді;
- егер ерітіндіде иондардың көбейтіндісі ерігіштік константасынан жоғары болса ИК˃Кs0, жүйе аса қаныққан болады да тұнба түзіледі. Тұнба түзілу процесі концентрациялар азайып тепе-теңдік орналғанша жүреді.
- егер жүйеде иондардың көбейтіндісі ерігіштік константасына тең болса
ИК=Кs0, ерітінді қаныққан болады, жүйеде динамикалық тепе-теңдік орын алады.
Ерігіштік константасын тепе-теңдік концентрациясы арқылы төмендегідей өрнектейді
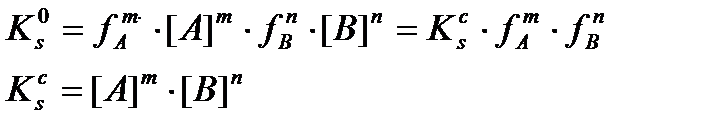 Бұл концентрациялық ерігіштік константасы, ол температураға, қысымға және иондық күшке тәуелді:
Бұл концентрациялық ерігіштік константасы, ол температураға, қысымға және иондық күшке тәуелді: 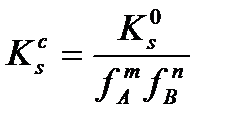
Өте нашар еритін электролиттерде ерітіндінің иондық күші I→0, f→1, сондықтан 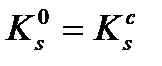 . Электролиттің ерігіштігі жоғары болса, немесе қатты фаза бөгде күшті электролит ерітіндісінде ерітілсе I≠0, f˂1. Бұндай жағдайда
. Электролиттің ерігіштігі жоғары болса, немесе қатты фаза бөгде күшті электролит ерітіндісінде ерітілсе I≠0, f˂1. Бұндай жағдайда 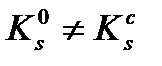 .
.
14. Ерігіштікке аттас иондардың әсері. Ерігіштікке күшті электролиттердің әсері. «Тұз эффектісі». Неғұрлым тұндырылатын қосылыстың ерігіштігі төмен болса, соғұрлым тұну процесі толық жүреді. Химиялық анализде тұндырылатын компоненттің ерітіндіде қалған мөлшері 10-6 моль/л –ден төмен болса, оны толық тұнбаға түсті деп есептейді.Тұнба түзілу процесіне ерітіндінің иондық күші, аттас иондар қосылуы, еріткіштің табиғаты, температура әсер тигізеді.
Аттас иондардың әсері. Тұндырғыштың артық мөлшері тұнатын компоненттердің иондық көбейтіндісінің (ИК) шамасын жоғарлатып, тұнбаның толық тұнуына ықтимал етеді. АВ нашар еритін қосылыс
АВ ↔А + В
Егер қосылыстың ерігіштігін SAB моль/л деп белгілесек, онда [A] = SAB моль/л және [B] =SAB моль/л. Қосылған аттас ионның концентрациясын С(Вқос.) белгілесек. Сонда Кs=S.(S+C(Bқос) Жақшаның ішіндегі S шамасы қосылған аттас ионның концентрациясынан көп кіші болғандықтан оны ескермеуге болады Кs=S.C(Bқос)
Ал ерігіштік келесі теңдеуден анықталады 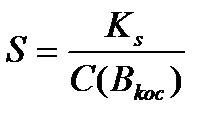
Бұл есептеулерден аттас иондар қатысында нашар еритін қосылыстардың ерігіштігі төмендейтіні көрінеді.
Электролиттің еруі біртекті ионды қосқанда ғана емес, кез келген ионды қосқанда байқалады. Оны «тұз эффектісі» деп атайды. Бұл құбылысты кез келген ион қосу кезінде ерітіндінің иондық күшінің артуымен түсіндіруге болады.
15. Титриметрлік талдау әдістерінің маңызы және реакция табиғатына қарай жіктелінуі (реакция теңдеуін келтіріңіз). Титриметрлік әдіс әрекеттесетін заттардың ерітінділерінің көлемдерін дәл өлшеуге негізделген. Сондықтан титриметрлік әдісті көлемдік әдіс деп атайды. Классикалық әдістерге кинетикалық және биохимиялық әдістерді де жатқызады. Мұнда аналитикалық сигнал ретінде реакция жылдамдығын қарастырады. Титриметриялық анализ әдістерінің классификациясы (жіктелуі) Титриметриялық анализ әдістерін анализде пайдаланылатын химиялық реакциялардың түріне қарай бөледі. Бұл реакциялар: протондар алмасатын, электрондар алмасатын, аз диссоциацияланатын (комплекстік) бөлшектер түзетін және нашар еритін қосылыстар түзетін реакциялар. Осыған байланысты титриметриялық анықтауды мынадай әдістерге бөлуге болады:
1. қышқыл-негіздік титрлеу (протолитометрия);
2. тотығу-тотықсыздану титрлеуі (редоксиметрия);
3. комплексометриялық титрлеу (комплексометрия);
4. тұнба алып титрлеу (седиметрия).
Титриметриялық әдістерді титрлеу жолына қарап та бөледі;
1. тікелей титрлеу әдісі – анықтайтын зат концентрациясы белгілі ерітіндімен титрленеді;
2. ауыстыру (жанама) әдісі – бұл әдіс анықтайтын зат пайдаланатын реагентпен әрекеттеспейтін, не реакция стехиометриялық жолмен жүрмейтін жағдайда пайдаланылады. Мысалы, кальций иондарын перманганатометрия әдісімен анықтау. Кальций иондарын қымыздық қышқылы аниондарымен тұнбаға түсіреді:
Ca2++C2O42-→CaC2O4↓
Жуылған тұнбаны күкірт қышқылында ерітеді:
CaC2O4↓+2H3O+→H2C2O4+Ca2++2H2O
Пайда болған қымыздық қышқылын калий перманганаты ерітіндісімен титрлейді:
5H2C2O4+2MnO4-+6H3O+ 10CO2+2Mn2++14H2O
3. кері титрлеу әдісі – анализдейтін ерітіндіге артық мөлшерде алынған титранттың белгілі көлемін құяды, яғни анықтайтын компонентпен реакция толық жүргеннен кейін ерітіндіде титранттың бос мөлшері қалады. Реакцияласпай қалған титранттың мөлшерін концентрациясы белгілі басқа ерітіндімен титрлейді. Алғашқы қосылған титранттың көлемі мен оның реакцияласпай артық қалған көлемінің арасындағы айырмашылық титранттың анықтайтын затпен әрекеттесуге кеткен көлемін көрсетеді.
16. Титриметрия әдісінде қолданылатын ерітінділер концентрацияларының түрлері(Сн, См, Та, Та\в) және олардың арасындағы байланыстар.
Титриметрлік талдау анықталатын компонентті анықтауға қажетті реактивтің мөлшерін (көлемін, массасын) өлшеуге негізделген. Анализ орындау үшін концентрациясы белгілі ерітінділер дайындалады.Титриметрлік талдауда жиі пайдаланатын концентрация түрлері: проценттік, мольдік концентрация, эквиваленттің мольдік концентрациясы және титр. Проценттік концентрация не заттың массалық үлесі төмендегі қатынастан анықталады:
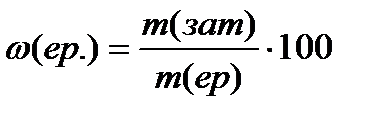
Мольдік концентрация дегеніміз – жүйедегі еріген заттың мөлшерінің (ν) осы жүйенің көлеміне қатынасы:
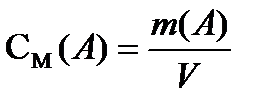 ;
; 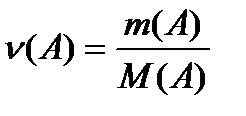 ;
;
Сонда 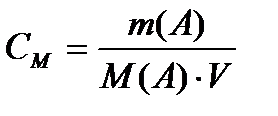 (көлем,л) яғни
(көлем,л) яғни 
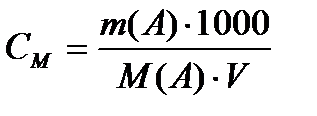 (көлем, мл).
(көлем, мл).
Эквиваленттің мольдік концентрациясы (нормальді концентрация) дегеніміз – жүйедегі еріген заттың эквивалент санының (n) осы жүйе көлеміне қатынасы:
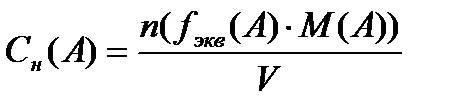 ;
; 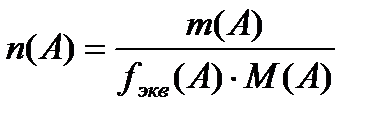
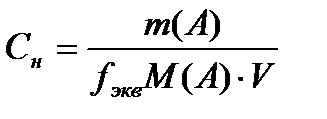 (көлем,л) немесе
(көлем,л) немесе 
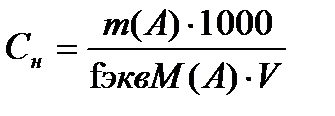 (көлем, мл)
(көлем, мл)
Титрлеу әдісімен қосылыстарды анықтау эквиваленттік нүктеде заттардың бір-бірімен эквивалентті мөлшерде әрекеттесуіне негізделген, яғни n(A) = n(B). n – заттың эквивалент саны. Жалпы түрде CH(A1) ·V(A1) = CH(B2)·V(B2). Эквиваленттер ережесі. Бұл титрлеу әдісінің негізгі теңдеуі. Осы теңдеуден кез-келген титрленетін жүйенің концентрациясын немесе көлемін анықтауға болады. Мысалы: 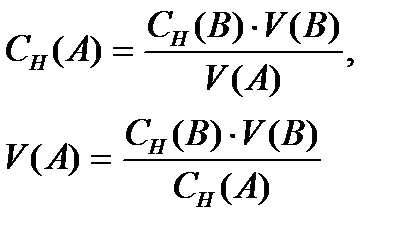
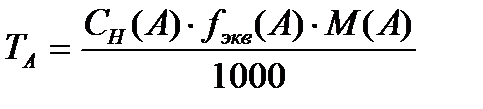
Анықталатын заттың массасы мен мольдік үлесін табуға болады: 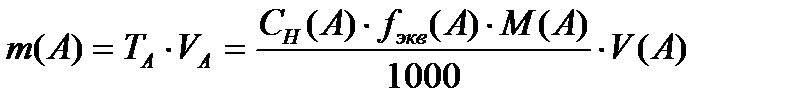
Егер В затымен титрлеп анықтасақ, онда 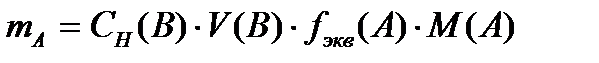 . Бірақ осындай теңдеулерді пайдалану үшін, титрант ретінде қолданылатын ерітіндінің концентрациясы белгілі болуы қажет (титрленген немесе стандартты ерітінді).
. Бірақ осындай теңдеулерді пайдалану үшін, титрант ретінде қолданылатын ерітіндінің концентрациясы белгілі болуы қажет (титрленген немесе стандартты ерітінді).
17. Әртүрлі химиялық реакциялардағы заттың химиялық эквиваленті, эквивалент факторы, эквиваленттік мольдік массасы. Қышқылды негіздік реакцияларда fэкв әрекеттесуге қатысқан сутек иондарының санымен, ал тт-тсзд реакцияларында тт, не тсзд реакциясына қатысқан электрондар санымен анықталады. fэкв мәні жүретін реакцияның теңдігіне байланысты бір сутегі ионына не бір электронға сәйкес (эквивалентті) заттың (ион, молекула, т.б.) үлесін көрсетеді. С(fэ,Х) конц арқылы берілген ерітіндідегі еріген заттың массасын табу үшін оның мольэквивалент санын бір мольэквиваленттің массасын n(Мэ) көбейту керек. Бір мольэквиваленттің массасы молярлық масса мен эквив фактордың көбейтіндісіне тең.
18. Эквиваленттік нүкте және титрлеудің соңғы нүктесі. Қышқылды негіздік титрлеудің индикаторлық қателер түрлері, есептеулері.
Титриметриялық анализдің дәлдігі ерітінділердің көлемін өлшейтін ыыдстың дәлдігімен шектеледі. Лабораториядағы өлшемдік ыдыстарды пайдаланып көлемдерді өлшегенде жіберілетін абсолютті қате ±(0,01-0,02) мл. Тек көлемді өлшеуге сәйкес салыстырмалы қате (СҚ): СҚ=±  V\V*100
V\V*100  (0,1-0,2)
(0,1-0,2)  Шындығында эквивалентті нүктені анықтағанда жіберілетін қатені еске алсақ титриметриялы қанализдің дәлдігі
Шындығында эквивалентті нүктені анықтағанда жіберілетін қатені еске алсақ титриметриялы қанализдің дәлдігі  0,5 болады. Индикаторлы қате эквивалентті нүкте мен титрлеуді ңсоңғы нүкиесінің сәйкес келмеуіне байланысты, яғни эквивалентті нүктедегі ерітіндінің рН мен пайдаланатын индикатордың титрлеу көрсеткішіне (рТ) сәйкес рН арасында айырмашылық болғаны. Сондықтан титрлеудің соңғы нүктесінде ерітіндіде не анықтайтын компоненттің, не титранттың артық мөлшері жүреді. Мысалы, НСl ерітіндісін NaOH ерітіндісімен титрлегенде pHэ.н.=7 болғанымен, индикатор ретінде метилді қызылды (рТ=5,5) немесе фенолфталеинді (рТ=9,0) пайдалануға болады. рТ мен (рНэ.н.) арасындағы айырмашылықтан туатын қатені индикаторлы қате д.а. Инд. қатені есептегенде олардың таңбасын көрсету қажет. Индикатордың мәніне байланысты
0,5 болады. Индикаторлы қате эквивалентті нүкте мен титрлеуді ңсоңғы нүкиесінің сәйкес келмеуіне байланысты, яғни эквивалентті нүктедегі ерітіндінің рН мен пайдаланатын индикатордың титрлеу көрсеткішіне (рТ) сәйкес рН арасында айырмашылық болғаны. Сондықтан титрлеудің соңғы нүктесінде ерітіндіде не анықтайтын компоненттің, не титранттың артық мөлшері жүреді. Мысалы, НСl ерітіндісін NaOH ерітіндісімен титрлегенде pHэ.н.=7 болғанымен, индикатор ретінде метилді қызылды (рТ=5,5) немесе фенолфталеинді (рТ=9,0) пайдалануға болады. рТ мен (рНэ.н.) арасындағы айырмашылықтан туатын қатені индикаторлы қате д.а. Инд. қатені есептегенде олардың таңбасын көрсету қажет. Индикатордың мәніне байланысты
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 3369; Нарушение авторских прав?; Мы поможем в написании вашей работы!