
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реактивы
|
|
|
|
Железоаммонийные квасцы. Растворяют 140 г соли в 1 л воды, содержа-
щей несколько миллилитров азотной кислоты; роданид калия, 0,05 М титро-
ванный раствор; раствор азотной кислоты с молярной концентрацией 6
моль/л.
Метод Фольгорда – роданометрический метод осадительного титрования,
основан на применении в качестве осадителя титрованного раствора, содер-
жащего ионы CNS ¯:
Аg+ + CNS ¯ → АgCNS↓
В качестве индикатора для определения точки эквивалентности исполь-
зуют раствор железоаммонийных квасцов. Этим методом пользуются для оп-
ределения галогенов и серебра. Метод может быть использован для опреде-
ления ионов в кислых растворах, в которых неприменим метод Мора. Тит-
рование можно проводить в кислой среде, лучше всего в 0,4 – 0,6 н. растворе
азотной кислоты.
Метод Фольгарда – это важнейший метод определения серебра. В нем
используется малая растворимость роданида серебра. Анализируемый рас-
твор титруют раствором роданида калия, о конце реакции узнают по образо-
ванию красного комплекса FeCNS 2+.
Мешающие ионы: никель, кобальт, свинец, медь, ртуть и другие метал-
лы, образующие комплексы с роданид-ионами. Мешают также ионы, связы-
вающие в комплексы ионы серебра и железа(III), а также вещества, окис-
ляющие роданид-ионы.
Выполнение эксперимента. К 5 мл анализируемого раствора прибавляют
5-10 капель 6 н. азотной кислоты и 3-5 капель раствора железоаммонийных
квасцов. Затем титруют раствором роданида до появления розовой окраски. При приближении к концу титрования раствор надо сильно перемешивать.
υ(1/z*Аg) = υ(1/z*NН4CNS);
С (1/z * NH 4 CNS) ⋅ V (NH 4 CNS) ⋅ M (1/z* Ag) ⋅ Vк
m(Ag) = 1000 Vп;
или m(Ag) = Т (NH 4 CNS / Ag) ⋅ V (NH 4 CNS)⋅ Vп
Vк;
где Vп – объем аликвотной части раствора определяемого вещества, мл;
Vк – общий объем исследуемого раствора, мл.
7 раздел 7. Фотоколориметрия, фотоэлектроколориметрия. Сущность методов. метод градуировочного графика, метод одного стандарта, определение концентрации по молярному (или удельному) коэффициенту погашения, метод добавок стандарта. Понятие о фотометрическом титровании.
Фотоколориметрический метод анализа основан на измерении поглощения света немонохроматического излучения окрашенными соединениями в видимой области спектра.
Если исследуемые соединения бесцветны, их переводят в-окрашенные соединения путем взаимодействия с различными-реактивами. В этом случае окрашенные соединения в большинстве своем являются комплексными или внутрикомилфсными соединениями. Последние должны быть прочными, иметц постоянный состав, высокую интенсивность окраски.
В зависимости от способа измерения концентрации веществ в окрашенных растворах, от применяемой аппаратуры методы фотоколориметрического анализа подразделяются в основном на два вида: визуальные и фотоэлектрические.
При визуальном методе, называемом колориметрическим, интенсивность окраски исследуемых растворов сравнивается с интенсивностью окраски стандартных растворов, в которых концентрация вещества известна.
При фотоэлектрических методах анализа интенсивность окраски, т. е. погашение окрашенного раствора исследуемого-вещества, измеряют с помощью приборов - фотоэлектроколориметров (ФЭК) или спектрофотометра в видимой области спектра.
Методы анализа, связанные с измерением поглощения света (спектрофотометрия, фотоколориметрия) базируются на объединенном законе Бугера - Ламберта - Бера, который устанавливает зависимость между поглощающей способностью исследуемого раствора, концентрацией вещества этого раствора и толщиной поглощающего слоя.
Согласно этому закону погашение (А) раствора прямо пропорционально концентрации раствора поглощающего вещества (С), толщине слоя (Ь) в сантиметрах и молярному или удельному показателю поглощения (х). Эта зависимость выражается формулой:
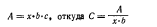
Основной принцип работы всех систем фотоэлектроколориметров заключается в том, что световой поток определенного интервала длин воли, прошедший через кювету с окрашенным раствором или растворителем, попадает на фотоэлемент, который превращает световую энергию в электрическую, измеряемую гальванометром.
Построение градуировочной кривой. Готовят ряд растворов стандартного образца1 данного вещества с известными концентрациями, измеряют погашения всех растворов и строят градуировочную кривую, откладывая по горизонтальной оси (абсциссе) известные концентрации, а по вертикальной (ординате) -соответствующие им значения погашения.
По градуировочной кривой в дальнейшем определяют неизвестную концентрацию вещества в исследуемых растворах. Для этого раствор наливают в ту же кювету, для которой построена градуировочная кривая, и, включив тот же светофильтр, определяют погашение. Затем по градуировочной кривой находят концентрацию, соответствующую измеренному значению погашения, градуировочную кривую следует время от времени проверять.
8 раздел 5. Потенциометрическое титрование. Сущность метода. Кривые потенциометрического титрования (интегральные, дифференциальные, кривые титрования по методу Грана).
Потенциометрическое титрование основано на определении эквивалентной точки по изменению потенциала на электродах, опущенных в титруемый раствор. При потенциометрическом титровании используют электроды как неполяризующиеся (без протекания через них тока), так и поляризующиеся (с протеканием через них тока).
Основы метода потенциометрического титрования
В процессе титрования определяется концентрация в растворе одного из ионов, для регистрации которого имеется подходящий электрод.
Потенциал Ех на этом индикаторном электроде устанавливается согласно уравнению Нернста.
Для образования электрической цепи в титруемый раствор помещают второй так называемый электрод сравнения, например каломельный, потенциал которого в процессе реакции остается постоянным. Потенциометрическое титрование на неполяризующихся электродах помимо упомянутых реакций окисления - восстановления используется также при реакциях нейтрализации. В качестве индикаторных электродов при реакциях окисления- восстановления применяют металлы (Pt, Wo, Mo). При реакциях нейтрализации применяют чаще всего стеклянный электрод, имеющий в широкой области характеристику, аналогичную водородному электроду.
При потенциометрическом титровании часто используют титрование не до определенного потенциала, а до определенной величины рН, например до нейтральной среды рН = 7. Несколько в стороне от общепринятых методов потенциометрического титрования (без протекания тока через электроды), рас смотренных выше, стоят методы потециометрического титрования при постоянном токе с поляризующимися электродами. Чаще применяют два поляризующихся электрода, но иногда пользуются и одним поляризующимся электродом.
В отличие от потенциометрического титрования с неполяризующимися электродами, при котором ток через электроды практически не протекает, в данном случае через электроды (обычно платиновые) пропускается небольшой (около нескольких микроампер) постоянный ток, получаемый от источника стабилизированного тока. В качестве источника тока может служить высоковольтный источник питания (около 45 в) с последовательно включенным относительно большим сопротивлением. Измеряемая на электродах разность потенциалов резко возрастает при приближении реакции к эквивалентной точке вследствие поляризации электродов. Величина скачка потенциала может быть гораздо больше, чем при титровании при нулевом токе с неполяризующимися электродами. Простота электродной цепи делает этот метод особенно удобным для автоматизации.
К достоинствам потенциометрического титровании относятся высокая точность и воспроизводимость анализов, возможность определять содержание компонентов в мутных и сильно окрашенных растворах, анализировать смеси, близкие по свойствам, кислот и оснований, окислителей и восстановителей без разделения. К недостаткам метода можно отнести мешающее влияние посторонних ионов на электродный потенциал, возможность «отравления» металлических электродов, инерционность электродов и некоторые другие.
Кривые потенциометрического титрования определяются приведенным выше уравнением Нернста и принадлежат к S-образному виду.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 379; Нарушение авторских прав?; Мы поможем в написании вашей работы!