
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрование слабой кислоты сильным основанием
|
|
|
|
3.3
Под стандартизацией раствора титранта понимают установление его точной концентрации с относительной погрешностью, не превышающей ±0,1%.
Различают приготовленные и установленные растворы титрантов. Приготовленные растворы точной концентрации получают растворением точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя. Так готовят, например, титрованный раствор NaCl.
Однако многие растворы, например титрованный раствор HCl, приготовить этим способом нельзя. В таких случаях готовят раствор титранта, концентрация которого известна лишь приблизительно, а затем его стандартизуют, т.е. устанавливают концентрацию точно. Эти растворы называют установленными. Для стандартизации растворов применяют специальные установочные вещества – первичные стандарты. Эти вещества должны иметь состав, точно отвечающий химической формуле, быть устойчивыми на воздухе и иметь по возможности большую молярную массу эквивалента *. Они должны быть также доступными и легко очищаться от примесей. Реакция титранта с раствором установочного вещества должна отвечать требованиям, которые предъявляются к титриметрическим реакциям, т.е. протекать быстро, количественно и стехиометрически.
Например, растворы NaOH и KOH часто стандартизуют по гидрофталату калия  или дигидрату щавелевой кислотыH2C2O4×2H2O, растворы HCl и H2SO4 – по карбонату натрия или буре Na2B4O7×10H2O, растворы перманганата калия – по оксалату натрия Na2C2O4 и т.д.
или дигидрату щавелевой кислотыH2C2O4×2H2O, растворы HCl и H2SO4 – по карбонату натрия или буре Na2B4O7×10H2O, растворы перманганата калия – по оксалату натрия Na2C2O4 и т.д.
Нередко для целей стандартизации используют вторичные стандарты, в качестве которых выступают титрованные растворы веществ, способных взаимодействовать с титрантом.
|
|
|
Как правило, стандартизацию титранта стремятся проводить в тех же условиях, какие будут при выполнении анализа.
3.4-3.5
Индикаторы – в-ва, которые меняют свое строение и физ свойства при изменении свойств среды. Чаще всего при этом изменяется цвет индикатора, иногда лиминисценция. Индикаторы кислотно-основного титрования меняют строение и свойства при измен pH среды и наз кислотно-основными индикаторами. С позиции протолитической теории различают индикаторы кислотного HInd и Ind типа. В р-ра индикаторы могут существовать в ионизирован и неионизирован формах, которые находятся в равновесии, зависящем от pH среды характеризуемой константой.
Индикаторы кислотного типа:
HInd → H+ + Ind -; KA = ([H+][Ind -]) / [HInd]
pKA = pH + lg [HInd] / ([H+][Ind -]);
Индикаторы основного типа:
Ind + H+ → IndH+ ; KB = [IndH+] / [Ind] [H+];
pKB = lg [Ind] / [IndH+] - pH
Ионизированная неионизированная формы индикаторов имеют различный цвет. Изменение цвета объясняется превращениями хромофорных групп молекуле индикатора. Наиб фенольные группы под воздействием щелочной среды способны переходить в хиноидные, придающие молекулы индикатора красный или малиновый цвет, вследствие образования системы сопряженной π связи.
При применении конц. ионов водорода в р-ре происходит сдвиг равновесия, количество одной из форм уменьшается, другой – возрастает и окраска р-ра изменяется.
Например ф/ф при [H+]>10-9 (pH<9) существует в осн. в бесцветной не ионизируемой форме, при [H+]>10-9 (pH>9) ионизируемой форме малиново-красного цвета (образование коллоидной формы). Изменения цвета индикатора происходит не сразу, скачком, а в некотором интервале с изменением pH, который называют интервалом перехода индикатора. Каждый индикатор имеет свой интервал перехода, который зависит от особенности структуры индикатора. Кроме интервала перехода индикаторы характеризуются показателем титрования pT, который равен pH середины перехода, когда 50% молекул индикатора перешло из одной формы в другую и концентрации обеих форм уравнялись:[Ind-]=[HInd]. В этом случае константа равновесия системы HInd/ Ind- также равна pH среды
|
|
|
pK= pH +lg [HInd] /[Ind-] =pH +lg1 =pH; pK =pK1=pT
Например м/о изменяет окраску от красной до желтой в интервале pH 3,1-4,4 и имеет показатель титрования pT =4,0 т.к. при pH=4 половина его молекул находиться в не ионизируемой, половина в ионизируемой форме.
Хромофорная теория индикаторов. Поведение индикаторов, объясняемое ионной теорией индикаторов, дополняется хромо-форной теорией индикато ров, согласно которой изменение окраски индикаторов связано с изменением структуры их молекул, внутримолекулярной перегруппировкой, вызываемой действием Н+ или ОН--ионов. По хромофорной теории в процессе изменения рН раствора меняется стро ение молекул кислотно-основных индикаторов. Это явление обусловливается бензоидно-хиноидной таутомерией. При изменении рН среды раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов является результатом изменений в их внутреннем строении. У одноцветных индика торов окраска изменяется в связи с появлением или исчезновением хромофо ров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие.
Типичным одноцветным индикатором является фенол-фталеин. При рН < 8 его молекулы не содержат хиноидной груп-пировки и поэтому бесцветны. Однако при добавлении раствора щелочи к раствору фенолфталеина (рН = 8) про исходит перегруппировка атомов в молекуле с образованием хиноидной груп пировки, которая обусловливает появление малиновой окраски раствора:
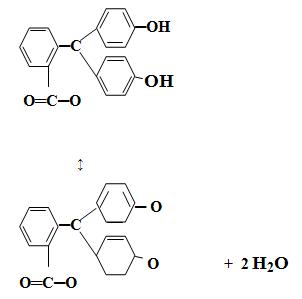
Дальнейшее увеличение рН до 13-14 вызывает другую пере-группировку, в результате чего получается трехзамещенная соль, лишённая хиноидной груп пировки и поэтому бесцветная:
Вследствие этого фенолфталеин обесцвечивается при действии большого избытка щелочи, например, натрия гидроксида. Типичным двухцветным индикатором является метиловый оранжевый:

(CH3)2N N═N SO3Na
При рН = 3,2...4,3 он оранжевый, при рН ≤ 3,1 приобретает красную, а при рН ≥ 4,4 - желтую окраску. Это объясняют присоединением ионов водорода кислоты к атому азота азогруппы индикатора, вследствие чего про исходит смещение электронов по всей системе, сопровождающееся обра зованием хиноидной структуры, которая обусловливает появление красной окраски раствора. Таким образом, при действии кислот наблюдают переход желтой окраски индикатора в красную, а при действии щелочей - обратное превращение:
|
|
|
(CH3)2N ═ ═N―N
ОН ↔
[(CH3)2N N═N SO3 ] + Н2 О
Цветность органических соединений, согласно хромофорной теории, обу словливается не только хиноидной структурой молекул, но и присутствием в них других хромофорных группировок (-N=N-, -N0 2, -NO, =С=С=, =С=О). При введении в молекулы органических веществ, содержащих хро мофорные группы, ряда других групп - ауксохромов (-ОН, -Nh4, -NHR, -NHR) происходит углубление цвета окрашенного вещества.
Ионно-хромофорная теория индикаторов. Согласно дополняющим друг друга ионной и хромофорной теориям, в раст-ворах кислотно-основных индикато ров одновременно сосущест-вуют равновесия, обусловливаемые диссоциацией молекул, и равновесия, связанные с внутримолекулярными перегруппировка ми (ионно-хромофорная теория). Для кислотно-основных индика-торов наи более характерными факторами, вызывающими измене-ние окраски, являют ся изменение соотношения количеств молеку-лярной и ионной форм индика тора, происходящее под влиянием кислот и щелочей, и появление или исчезновение хромофорных групп или же превращение одних хромофорных групп в другие.
Способность молекул различных индикаторов диссоциировать в нейтраль ной среде характеризуют константами диссоциации. Например, у метилового оранжевого Кa≈ 10 -4, у лакмуса Кa ≈ 10 -8, а у фенолфталеина Кa ≈ 10-9. Следо вательно, фенолфталеин является наиболее слабой органической кислотой из этих индикаторов.
Известно, что прибавление к любому раствору любой кислоты или щело чи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индика-торов также связана с измене нием рН раствора. Однако каждый индикатор изменяет окраску только в определенном, ха рактерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоци-ированной и недиссоциированной форм, то есть от отношения:
|
|
|
KHInd=[H+][Ind-] / [HInd]
[Ind-] / [HInd] = KHInd / [H+] или [HInd] / [Ind-] = [H+] / KHInd.
Когда KHInd = [Н+], то [Ind-] / [HInd] = 1.
Если КHInd / [Н+] > 1, то в растворе превалирует диссоцииро-ванная форма индикатора, а если КHInd / [Н+] < 1, то превалирует недиссоциированная форма.
При одной и той же концентрации ионов водорода отношение КHInd / [Н+] будет тем больше, чем больше КHInd.
Для фенолфталеина КHInd = [Н+] [Ind-] / [HInd] ≈ 10-9.
При рН = 7 [Н+] = 10 -7, а [HInd] / [Ind-] = 10-7 / 10-9, то есть при рН = 7 на каж дые 100 бесцветных молекул фенолфталеина приходится лишь 1 окрашенный ион, следовательно, раствор - бесцветный. Если к раствору фенолфталеина прибавить щелочь и довести рН раствора до 8, то соотношение [HInd] / [Ind -] = 10 -8 /10-9 (уменьшится в 10 раз), и раствор станет бледно розовым. А при рН=9 соотношение [HInd] / [Ind-] = 10-9 / 10-9 = 1, то есть в растворе присутствуют равные количества бесцветных молекул индикатора и окрашенных в красный цвет ионов и раствор приобретает розовую окраску.
Таким образом, переход ная окраска индикатора появляется при рН среды, равном рКHInd, но так как изменение цвета индикатора происходит постепенно, цвет недиссоциирован ных молекул индикатора начинает маскироваться цветом ионов задолго до достижения соотношения [HInd] / [Ind-] = 1.
Следовательно, цвет водного раствора индикатора определяется соотноше нием концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+]. Величину рН, до которой титруют раствор с дан ным индикатором, называют показателем титрования этого индикатора рТ.
Важнейшие индикаторы имеют следующие области перехода и показатели титрования:
Показатель титрования рТ Область перехода рН
Метиловый оранжевый…4,0…………… 3,1 - 4,4
Метиловый красный….. 5,5…………… 4,4 - 6,2
Лакмус……………… ……7,0…………… 5,0 - 8,0
Фенолфталеин……………9,0………….. 8,0 - 10,0
КРИВЫЕ ТИТРОВАНИЯ. ВЫБОР ИНДИКАТОРА
Кривая кислотно-основного титрования - это графическое изображение изменения рН раствора в ходе титрования.
Титрование сильной кислоты сильным основанием.
Допустим, что для титрования взяли 20 см3 раствора 0,1 моль/дм3 HCl, а в качестве титранта использовали раствор 0,1 моль/дм3 NaOH. Поскольку каждая молекула НСl дает при диссоциации один ион Н+, об щая концентрация водородных ионов в 1 дм3 исходной 0,1 моль/дм3 кислоты составляет 0,1 (или 10 -1) моль-ион. Следовательно, рН этого раствора равен 1.
Когда 90 % соляной кислоты будет оттитровано, ионов Н+ останется 10 % от первоначального количества, то есть 0,01 (или 10-2) моль-ион в 1 дм3, а рН раствора станет равен 2. При нейтрализации 99,0 % соляной кислоты рН = 3; при нейтрализации 99,9 % кислоты рН = 4 и т. д. В момент полной нейтрали зации соляной кислоты титруемый раствор содержит только натрия хлорид и имеет рН = 7. Прибавление избытка натрия гидроксида ведет к увеличению рН раствора, как это показано в табл. 3.1.
Результаты этих вычислений изображают графически. На оси абс-цисс откладывают избыток кислоты или щелочи в разные моменты титрования, а на оси ординат - соответствующие значения рН раствора. Получающийся гра фик называют кривой титрования.
Ход этой кривой свидетельствует, что в конце титрования сильной кислоты сильным основанием происходит резкий скачок в измене-нии рН раствора. К моменту нейтрализации 99,9 % кислоты рН по степенно растет от 1 до 4, то есть всего на три единицы, а при переходе от 0,1 % остатка НСl к 0,1 % избытку NaOH рН раствора резко увеличивается с 4 до 10. Это означает, что добавление одной капли щелочи в конце титрова ния понижает концентрацию ионов Н+ с 10 -4 до 10 -10 моль в литре или в миллион раз.
Изменение рН раствора при титровании сильной кислоты сильным основанием
| Прибавлено NaOH | Осталось HCl | [H+], моль/дм3 | рН | |||||||
| % | мл | % | моль/дм3 | |||||||
| 0,0 90,0 99,0 99,9 | 0,0 18,00 19,80 19,98 | 100,0 10,0 1,0 0,1 | 0,1 0,01 0,001 0,0001 | 10 -1 10 -2 10 -3 10 -4 | ||||||
| 100,0 | 20,00 | 0,0 | 10 -7 | 10-7 | ||||||
| Избыток NaOH | ||||||||||
| 100,1 101,0 110,0 200,0 | 20,02 20,20 22,00 40,00 | 0,1 1,0 10,0 100,0 | 0,0001 0,001 0,01 0,1 | 10 -10 10 -11 10 -12 10 -13 | ||||||
В результате резкого из менения рН раствора от по следней капли раствора основания происходит и рез кое изменение окраски индикатора. При отсутствии скачка рН на кривой титро вания окраска индикатора изменялась бы постепенно и определить точку эквивалентности было бы невоз можно.
Кривую титрования слабой кислоты сильным основанием рассчитывают несколько иначе, так как при этом концентрацию ионов Н+ уже нельзя при равнивать к общей концентрации кислоты. Ее приходится вычислять с уче том константы диссоциации кислоты. Не вдаваясь в подробности вычислений, приведем кривую титрования раствора 0,1 моль/дм3 уксусной кис лоты раствором 0,1 моль/дм3 NaOH (рис.3.2). Интервал скачка рН на ней значительно уже, чем в первом случае. Он простирается от рН = 7,8 (остатка кислоты в 0,1 %) до рН = 10 (∆pH = 2,2 избытка щелочи в 0,1 %). Слабая уксусная кислота посылает в раствор гораздо меньше ионов Н+, чем хлороводородная. Поэтому перед началом титрования рН раствора 0,1 моль/дм3 уксусной кислоты равен 3, а не 1, как в случае с хлороводородной кислотой. В ходе титрования рН раствора уксусной кислоты все время остается выше, чем при тех же концентрациях хлороводородной кислоты. Поэтому и скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и впервом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/дм3 NaOH.
Получающийся в результате титрования натрия ацетат СН 3СООNа гидролизуется с образованием некоторого избытка ионов ОН -. В связи с этим при титровании слабой кислоты сильной щелочью точка эквивалентности не совпадает с точкой нейтральности. Она лежит в щелочной области при рН = 8,9.
Для титрования слабой кислоты сильным основанием пригоден индикатор фенолфталеин. Его показатель титрования входит в пределы скачка рН на кривой и почти совпадает с точкой эквивалентности. Другие индикаторы (метиловый оранжевый, метиловый красный и даже лакмус) не могут быть использованы в этом случае, так как показатели титрования их не входят в интервал скачка.
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 914; Нарушение авторских прав?; Мы поможем в написании вашей работы!